Классификация химических реакций.
Все кинетические реакции различают по молекулярности и порядку реакции. Молекулярность реакции определяется числом молекул, участвующих в элементарном акте химического взаимодействия. По этому признаку реакции разделяются на мономолекулярные, бимолекулярные и тримолекулярные.
Мономолекулярными называются такие реакции, в которых в элементарном акте взаимодействия участвует одна молекула, например реакции разложения или радиоактивного распада:
I2 = 2I
Сюда же относятся реакции изомерного превращения сложных молекул в газах и растворах. Примером такой реакции в газовой фазе может служить мономолекулярная реакция распада азометана:
CH3N2CH3 = С2Н6 + N2
Бимолекулярными называются реакции, в которых в элементарном акте взаимодействия участвуют две молекулы. Например, реакция образования йодистого водорода:
Н2 + I2=2HI
или реакция превращения йодистого нитрозила:
N0I+ N0I = 2N0 + I2
К этому типу реакций относятся также реакции этерификации сложных эфиров и многие другие.
Тримолекулярными называются реакции, в которых в элементарном акте взаимодействия участвуют три молекулы. Например:
2N0 + 02 = 2NO2
Одновременная встреча в элементарном акте взаимодействия трех молекул случается довольно редко. Реакции же более высокой молекулярности вообще неизвестны. В тех случаях, когда из химического уравнения следует, что в реакции участвует большее число молекул, процесс на самом деле происходит более сложным путем — через две и большее число промежуточных стадий моно- или бимолекулярных реакций.
Каждому типу реакции отвечает свое кинетическое уравнение, которое выражает зависимость скорости химической реакции от концентрации реагирующих веществ. По форме зависимости υ =f(C) различают реакции первого, второго и третьего порядков. Скорость реакции первого порядка пропорциональна концентрации исходных веществ в первой степени. В реакциях второго и третьего порядков скорость соответственно зависит от концентрации во второй и третьей степени. В общем случае порядком реакции называют сумму показателей степеней, скоторыми концентрацииреагентоввходят в экспериментально найденное кинетическое уравнение. Так, для реакции типа
п1А + п2В= n3С + n4D
порядок реакции n=n1+ n2.
Казалось бы, порядок реакции легко можно определить по виду стехиометрического уравнения. Однако опыт показывает, что порядок, по которому развивается реакция во времени, часто не совпадает с порядком, определяемым по стехиометрическому уравнению. Иными словами, порядок реакции не всегда совпадает с ее молекулярностью. Лишь в наиболее простых случаях наблюдается это совпадение. Реакция может быть бимолекулярной, но протекать по кинетическому уравнению реакции первого порядка и т. п. Примером могут служить реакции гидролиза уксусноэтилового эфира и тростникового сахара в разбавленном водном растворе:
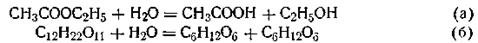
В этих реакциях концентрация воды изменяется ничтожно мало, и скорость реакции зависит только от изменения концентрации эфира (а) или тростникового сахара (б). Поэтому кинетика этих бимолекулярных реакций соответствует уравнению кинетики мономолекулярных реакций. В общем случае, если в реакции одно из веществ находится в большом избытке, порядок реакции, как правило, снижается.
Причина несовпадения порядка и молекулярности реакции объясняется тем, что стехиометрическое уравнение реакции описывает процесс в целом и не отражает истинного механизма реакции, протекающей через ряд последовательных стадий.
Дата добавления: 2016-02-20; просмотров: 983;
