Реакции второго порядка.
К реакциям второго порядка относятся реакции соединения типа A + B→C, реакции обмена A + B = C + D, а также реакции разложения и др. Скорость реакции второго порядка определяется уравнением
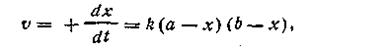
| 2.13 |
где k — константа скорости реакции; а — число молей вещества А в начале реакции; b — число молей вещества В в начале реакции; х—число прореагировавших молей.
Здесь возможны два случая. Первый случай — это когда какое-то количество вещества А вступает в реакцию с эквивалентным количеством вещества В, т. е. когда а = b. И второй случай более сложный — это когда а ≠ b. Рассмотрим оба эти случая.
Первый случай (а= b).Поскольку исходные концентрации реагирующих веществ равны между собой, уравнение (2.13) примет вид
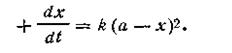
| 2.14 |
Разделяя переменные и производя интегрирование, получим
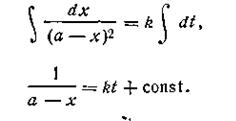
| 2.15 |
При t = 0 x = 0, откуда const =1/а. После подстановки этой величины в уравнение (2.15) получим
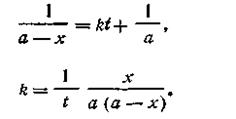
| 2.16 |
Размерность константы скорости реакции второго порядка t-1C-1. Поэтому в отличие от константы скорости первого порядка численное значение k зависит от того, в каких единицах выражены t и С. Если последняя выражена в кмоль/м3, а время в с, то k имеет размерность [с-1·(кмоль/м3)-1].
Для реакций второго порядка большую роль играет число столкновений, которые происходят в единицу времени между молекулами реагирующих веществ. Число столкновений, в свою очередь, пропорционально числу молекул в единице объема, т. е. концентрации. Таким образом, константа скорости, а следовательно, и скорость реакции второго порядка зависят от разбавления раствора.
Второй случай (а ≠ b). Если для реакции взяты неэквивалентные количества реагирующих веществ, скорость реакции выразится так:
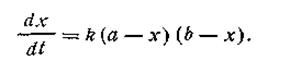
| 2.17 |
После разделения переменных получим это уравнение в другом виде:
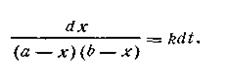
| 2.18 |
Выражение, стоящее в левой части уравнения (2.18), можно представить как
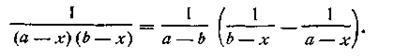
| 2.19 |
Поcле подстановки этого выражения в уравнение (2.13) получим
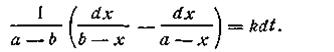
| 2.20 |
После интегрирования
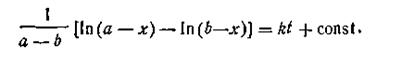
| 2.21 |
Поскольку при t = 0 х = 0, постоянная интегрирования

| 2.22 |
Подставляя это выражение в уравнение (2.16), найдем
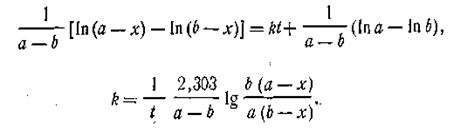
| 2.23 |
Это и есть кинетическое уравнение реакции второго порядка. Примером подобной реакции может служить омыление эфиров щелочами:
СН3COOC2Н5 + ОН- →СН3COO- + C2Н5ОН
Кинетика реакций второго порядка была детально изучена С. Г. Крапивиным еще в 1915 г.
Реакции третьего порядка встречаются очень редко и потому не имеет смысла рассматривать математический вывод их кинетического уравнения.
Существуют экспериментальные способы определения порядка реакции, основные из них:
избыточных концентраций,
подстановки в кинетическое уравнение реакций,
определение полупериода реакций,
графический.
Сложные реакции.
Сложными называются реакции, общее кинетическое уравнение которых в отличие от кинетического уравнения простых реакций содержит несколько констант скоростей. К сложным реакциям относятся обратимые, параллельные, последовательные, сопряженные, цепные и другие реакции. Теория всех этих реакций основана на положении, что при протекании в системе одновременно нескольких реакций каждая из них проходит самостоятельно и к каждой из них в отдельности применимы уравнения кинетики простых реакций.
Параллельными реакциями называются реакции вида
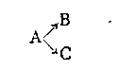
т. е. при которых одни и те же исходные вещества, одновременно реагируя, образуют разные продукты. Примером подобного типа реакций является реакция разложения бертолетовой соли КСlO3, которая может идти в двух направлениях:
Примером последовательных реакций может служить гидролиз рафинозы трисахарида, который происходит через стадии образования дисахарида, а последний образует уже моносахариды:
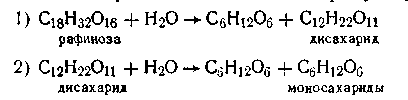
Расчет кинетики последовательных реакций в общем виде очень сложен и здесь не рассматривается. Отметим только, что если одна из ступеней обладает значительно меньшей скоростью, чем остальные, то общая скорость реакции определяется скоростью именно этой ступени.
Сопряженными реакциями называются реакции, которые протекают по следующей схеме:
1)A + В→М
2)A + C→N
Реакция 1 может протекать самостоятельно, в то время как реакция 2 проходит при наличии реакции 1. Так, сульфат железа окисляется пероксидом водорода независимо от присутствия йодистого водорода. Последний же в чистом виде пероксидом водорода не окисляется, но при окислении сульфата железа окисляется одновременно с ним.
Обратимыми называются такие реакции, скорость которых равна разности между скоростями прямой и обратной реакции:
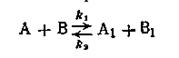
Примером обратимой реакции, может служить реакция образования сложного эфира
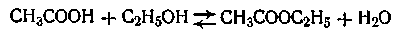
В этом случае скорость прямой реакции с течением времени убывает, а скорость обратной реакции возрастает до тех пор, пока обе скорости не выравняются и не наступит так называемое состояние динамического равновесия. Константа равновесия данной реакции равна отношению констант скоростей прямой и обратной реакции.
Наряду с рассмотренными выше реакциями, механизм которых сравнительно прост, существуют также реакции, в которых взаимодействие осуществляется более сложным путем. Примером подобных реакций являются цепные реакции, которые имеют исключительно большое значение в химической технологии, так как на них основаны такие процессы, как полимеризация, крекинг нефти, деление атомного ядра.
К цепным реакциям относится большая группа реакций, протекающих путем образования цепи следующих друг за другом реакций, в которых участвуют активные частицы с ненасыщенными свободными валентностями — так называемые свободные радикалы. Свободные радикалы образуются за счет дополнительного поглощения энергии при разрыве связей в молекуле, при электрическом разряде, при поглощении электромагнитных колебаний, а также за счет других внешних источников энергии.
Сущность цепного механизма реакции заключается в том, что активная молекула, реагируя, порождает новую активную молекулу или реакционноспособную частицу (валентно-ненасыщенные свободные атомы или радикалы). Процесс исчезновения и регенерации каждой активной частицы в дальнейшем циклически повторяется много раз и создает цепь превращений, совершающихся частью последовательно, а частью параллельно.
Впервые определение цепного механизма реакций через образование активных центров было дано Н. А. Шиловым (1904). Чрезвычайно большой вклад в дело изучения цепных реакций внес Н. Н. Семенов, которому за эти исследования была присуждена Нобелевская премия.
В настоящее время цепные реакции изучены настолько хорошо, что стало осуществимо регулирование скорости этих реакций. Добавляя вещество, легко вступающее во взаимодействие с активными центрами, можно значительно увеличить число обрывов цепей и тем самым затормозить (или же прекратить вовсе) цепную реакцию.
Например, добавление всего лишь 0,01% NС1з (треххлористого азота) к смеси водорода и хлора (Н2 и С2), которые реагируют по типу цепных нарастающих реакций, уменьшает скорость образования хлористого водорода в десятки тысяч раз.
Некоторые добавки увеличивают скорость цепных реакций. Так, добавление сравнительно малых количеств N0 в значительной степени ускоряет цепные реакции окисления углеводородов. При этом удается значительно понизить температуру процесса окисления, что очень важно, так как сохраняются от сгорания ценные промежуточные продукты — уксусный и муравьиный альдегиды.
На цепных химических реакциях основаны многие технологические процессы — синтез спиртов, кетонов, формалина, уксусной кислоты.
В последнее время исследования показали, что некоторые биологические процессы также протекают по типу цепных реакций, в частности процессы биологического окисления.
Дата добавления: 2016-02-20; просмотров: 4901;
