Реакции первого порядка.
К реакциям первого порядка относятся такие, в которых скорость химической реакции связана с концентрацией (С) реагирующих веществ следующим уравнением: υ= kC, или согласно уравнению (2.03)
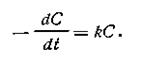
| 2.05 |
Если обозначить через а начальную концентрацию вещества до реакции, а через (а—х) концентрацию вещества в конце реакции, где х — число молей вещества, прореагировавшего за время t, и подставить эти значения в уравнение (2.05), получим
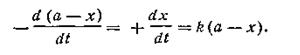
| 2.06 |
Перепишем уравнение (2.06) в таком виде:
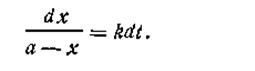
| 2.07 |
Интегрируя уравнение, получим
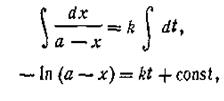
| 2.08 |
где const — постоянная интегрирования, которая определяется из условия, что в начале опыта t = 0 и х=0. Подставив эти значения в уравнение (2.08), найдем const = —ln а. Подставляя эту величину в уравнение (2.05), получим:
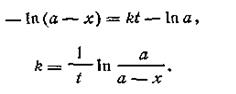
| 2.09 |
Перейдя от натуральных логарифмов к десятичным, получим кинетическое уравнение реакции первого порядка в следующем виде:

| 2.10 |
Константа скорости мономолекулярной реакции показывает долю, которую составляют молекулы, вступившие в реакцию за единицу времени, от общего числа молекул, имеющихся в данный момент. Уравнение (2.10) дает возможность вычислить концентрацию реагирующего вещества в любой момент времени по известной величине константы скорости или найти константу скорости реакции при заданной температуре путем определения концентрации в любой момент времени. Из уравнения (2.10) следует, что размерность константы скорости реакции первого порядка t-l, т. е. 1/с. Скорость реакции первого порядка не зависит от объема (разбавления), в котором протекает реакция. Иными словами, в единицу времени превращению подвергается одна и та же часть вещества.
Наряду с константой скорости реакции первого порядка характеризуются также периодом полураспада τ (греч. «тау»), который обозначает время, в течение которого превращается ровно половина взятого количества вещества. Короче говоря, τ есть такой промежуток времени, в течение которого первоначальная концентрация вещества а уменьшается до а/2, т. е. х = а/2. Если подставить в уравнение (2.10) вместо х значение а/2 и вместо t значение τ, получим
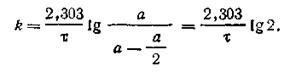
| 2.11 |
Так как lg 2 = 0,301, то
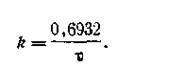
| 2.12 |
Из уравнения (2.12) следует, что константа скорости реакции первого порядка находится в обратно пропорциональной зависимости от периода полураспада.
Дата добавления: 2016-02-20; просмотров: 838;
