МЕТОДИКА КАЛОРИМЕТРИЧЕСКИХ ИЗМЕРЕНИЙ
Теплоту процесса можно определить в приборе – калориметре, где наблюдают вызванное этим процессом изменение какого-либо параметра, чаще всего, температуры ( иногда объема или давления).
В простейших случаях при определении теплового эффекта в жидких системах калориметр может состоять из 2-х вставленных друг в друга и изолированных стаканов (внутреннего и внешнего), мешалки и термометра (рис. 1.7).

Рис. 1.7 Изотермический калориметр
Основным калориметрическим уравнением (независимо от типа калориметра) является:

 ,(1.74)
,(1.74)
где: Q - тепловой эффект процесса, кДж/моль;
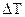 - изменение температуры в калориметре в результате процесса;
- изменение температуры в калориметре в результате процесса;
n - количество молей основного компонента;
К - постоянная калориметра, то есть количество тепла, которое нужно сообщить калориметру, чтобы изменить температуру всех его частей на один градус (теплоемкость калориметра), кДж/град.
Определение Δ Тсостоит из трех периодов: подготовительного, главного и заключительного.
В подготовительном периоде в течение 8-10 мин (каждую минуту) измеряют и записывают температуру жидкого компонента (250-300 см3) при постоянном перемешивании. Данные калориметрического опыта заносят в таблицу (содержащую не менее 30 строк).
Таблица 1.4 Данные калориметрического опыта
| Время, Мин | Температура, Т 0С | |
| Стандарт | Исследуемое вещество | |
| 1. | ||
| 2. |
В главном периоде, приподняв крышку калориметра, засыпают 6 г соли, предварительно взяв точную навеску, и, не прекращая перемешивания, продолжают измерение температуры через каждую минуту, пока растворение не закончится (до прекращения резкого изменения температуры). Затем продолжают измерения еще в течение 8-10 мин – это заключительныйпериод. Данные заносят в таблицу 1.4.
По полученным данным строят график в координатах
Т = f (время, мин). Изменение температуры ( 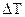 ) находят графически: через экспериментальные точки заключительного и подготовительного периодов проводят прямые, выделяют главный период, из его середины проводят перпендикуляр к оси абсцисс, и по точкам пересечения этого перпендикуляра с прямыми подготовительного периода находят
) находят графически: через экспериментальные точки заключительного и подготовительного периодов проводят прямые, выделяют главный период, из его середины проводят перпендикуляр к оси абсцисс, и по точкам пересечения этого перпендикуляра с прямыми подготовительного периода находят 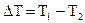 (см. рис. 1.8).
(см. рис. 1.8).
Для определения постоянной калориметра (К), необходимо провести процесс растворения вещества, тепловой эффект которого известен (см. Приложение, табл. 6). Определив 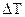 для этого процесса, как описано выше, и рассчитав количество молей вещества, взятого для реакции
для этого процесса, как описано выше, и рассчитав количество молей вещества, взятого для реакции
 , где: g - навеска вещества, г;
, где: g - навеска вещества, г;
М – его молекулярная масса, г/моль.
определяют К по формуле:
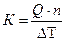 , (1.75)
, (1.75)
После чего, проведя процесс с исследуемым веществом и используя уравнение (1.74), определяют тепловой эффект изучаемого процесса.
Температура, Температура,
0С 0С
 |  |













10 20 10 20
Время, мин
Рис. 1.8. Примерный вид кривых калориметрического опыта:
а – при экзотермическом процессе;
б – при эндотермическом процессе.
Для определения теплоты гидратации (зад. 2) необходимо определить тепловой эффект растворения безводной ( 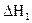 ) и гидратированной (
) и гидратированной ( 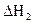 ) солей и по разности рассчитать теплоту гидратации (DНгидр.):
) солей и по разности рассчитать теплоту гидратации (DНгидр.):
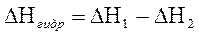 ,(1.76)
,(1.76)
При определении теплоты взаимодействия почвы с водой (зад. 3) берут навеску почвы в 10 г. Расчет проводят на 1 кг почвы (кДж/кг почвы).
Рассчитывают ошибку опыта и делают выводы.
ТЕМА 2.
Дата добавления: 2016-02-20; просмотров: 1668;
