Третье начало термодинамики
Третье начало термодинамики, или тепловая теорема, было сформулировано Нернстом в 1906 г. и потому часто называется его именем. Большое значение в развитии этой теоремы имели работы М. Планка (1911). Тепловая теорема Нернста имеет следующую формулировку: при абсолютном нуле энтропия любого однородного тела равна нулю.
При этом делается допущение, что при T→0 зависимость теплового эффекта и максимальной работы для конденсированных систем выражается равенством
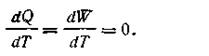
| 1.73 |
Из уравнения (1.73) следует, что W = 0.
Согласно третьему закону термодинамики уравнение (I.73) при T→0 принимает вид
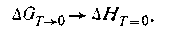
Таким образом, изменение изобарно-изотермического потенциала реакции становится равным изменению энтальпии. Расхождение между этими функциями состояния увеличивается с повышением температуры. Другими словами, с повышением температуры направление химической реакции зависит уже от двух факторов — от знака изменения энтальпии и от значения изменения энтропии.
В 1907 г. Эйнштейн доказал, что теплоемкость твердых тел при абсолютном нуле (Т=0) должна быть равна нулю. Благодаря тепловой теореме Нернста оказалось возможным определять абсолютную величину энтропии на основании измерения теплоемкостей при разных температурах. На основании этой теоремы можно вывести известные соотношения, которые позволяют по тепловому эффекту реакции вычислять ее свободную энергию, а зная последнюю, можно предсказать и направление реакции.
Вопросы для самоподготовки
1. Дайте определение основных термодинамических понятий (система, фаза, компонент и др.).
2. Назовите основные термодинамические процессы и функции их определяющие.
3. Сформулируйте 1-ый и 2-ой законы термодинамики. Запишите их математические выражения.
4. Закон Гесса – основной закон термохимии. Опишите методы определения тепловых эффектов реакции.
5. Дайте понятие энтропии, свободной энергии и максимальной работы. Как изменяется энтропия в процессе жизнедеятельности и гибели биологической системы.
6. Сформулируйте третье начало термодинамики и дайте понятие химического потенциала.
Дата добавления: 2016-02-20; просмотров: 1040;
