Химическая кинетика реакций. Основные положения и понятия.
Химической кинетикой называется учение о скорости химических реакций и ее зависимости от различных факторов — природы и концентрации реагирующих веществ, давления, температуры, катализаторов.
Скорости химических реакций могут значительно различаться. Например, некоторые реакции совершаются в тысячные доли секунды (взрыв), другие же протекают в течение значительно более длительного времени. Так, ржавчина на железе становится заметна уже через несколько часов после того, как оно пришло в контакт сводой или влажным воздухом, а образование антрацита в земной коре протекает в течение сотен и тысяч лет.
Вопрос о скорости химических реакций имеет исключительно большое практическое и теоретическое значение. От скорости реакции в различных технологических процессах зависят производительность и габариты заводской аппаратуры, течение тех или иных биологических процессов, эффективность действия на живой организм различных лекарственных препаратов.
Чтобы получить в единицу времени наибольшее количество вырабатываемого продукта, необходимо максимальное увеличение скоростей реакций, лежащих в основе того или иного химического процесса. С другой стороны, вредные, нежелательные процессы — коррозию металлов, окисление каучука — необходимо как можно больше замедлить. Поэтому изучение законов химической кинетики, открывающее путь к сознательному регулированию скоростей реакций, имеет исключительно важное значение для практики. Управление химическим процессом является главной задачей химической кинетики.
Прежде чем приступить к обсуждению закономерностей, управляющих развитием реакции, остановимся на самом понятии скорости химической реакции.
 Под скоростью реакции понимают изменение концентрации реагирующих веществ в единицу времени. При этом концентрацию обычно выражают числом молей вещества на единицу объема реакционной смеси (обычно — на 1 л), время—в секундах, минутах и т. п. Чтобы вычислить скорость реакции, необходимо знать, насколько изменилась концентрация одного из реагирующих веществ в единицу времени. Например, за какой-то промежуток времени ∆t=t2—t1концентрация реагирующих веществ уменьшается на
Под скоростью реакции понимают изменение концентрации реагирующих веществ в единицу времени. При этом концентрацию обычно выражают числом молей вещества на единицу объема реакционной смеси (обычно — на 1 л), время—в секундах, минутах и т. п. Чтобы вычислить скорость реакции, необходимо знать, насколько изменилась концентрация одного из реагирующих веществ в единицу времени. Например, за какой-то промежуток времени ∆t=t2—t1концентрация реагирующих веществ уменьшается на
—∆С=С1—С2 (рис.2.1). Тогда средняя скорость реакции за промежуток времени ∆t:

| 2.01 |
Знак минус в правой части выражения (2.0l) означает, что концентрация реагирующих веществ, а следовательно, и скорость химической реакции уменьшаются.
 Средняя скорость не отражает истинной скорости в каждый момент времени, поэтому математически истинную скорость υреакции в данный момент принято выражать отношением бесконечно малого изменения концентрации dC к бесконечно малому отрезку времени dt, в течение которого произошло изменение концентрации:
Средняя скорость не отражает истинной скорости в каждый момент времени, поэтому математически истинную скорость υреакции в данный момент принято выражать отношением бесконечно малого изменения концентрации dC к бесконечно малому отрезку времени dt, в течение которого произошло изменение концентрации:
| 2.02 |
Скорость химической реакции по закону действия масс пропорциональна концентрации реагирующего вещества в данный момент времени. Так, для реакции типа А→В скорость реакции может быть выражена следующим кинетическим уравнением:
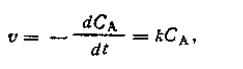
| 2.03 |
где Са — концентрация вещества А в данный момент; k — коэффициент пропорциональности, который носит название константы скорости химической реакции.
При взаимодействии двух веществ или более, т. е. для реакций типа
mA + nB→ pC,
математическое выражение скорости будет
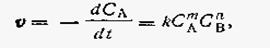
| 2.04 |
где С а и СВ — концентрации веществ А и В в данный момент времени. Таким образом, скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Причем стехиометрические коэффициенты входят в уравнение скорости в виде показателя степени при соответствующих концентрациях.
Коэффициент пропорциональности, или константа скорости химической реакции, не меняется при изменении концентраций А и В. Иногда k называют еще удельной скоростью реакции, т. е. скоростью реакции при концентрациях реагирующих веществ, равных единице. Удельная скорость реакции зависит от природы реагирующих веществ, температуры, присутствия посторонних примесей (в частности, катализатора), а также среды, в которой протекает реакция. Значение k зависит также от выбора единиц концентрации и времени.
Чем больше константа скорости k, тем быстрее идет реакция.
Дата добавления: 2016-02-20; просмотров: 1280;
