Практическое занятие 5: Термохимия и термохимические расчеты
Цель занятия: Изучение фундаментальных законов и основных понятий химической термодинамики для понимания способов и возможностей управления процессами, используемыми в современной промышленности. Формирование и закрепление навыков расчета термодинамических функций и анализа состояния химических систем.
Требования к знаниям, которые студент должен приобрести в результате освоения темы:
знать:фундаментальные положения химической термодинамики, закон Гесса,
иметь представление: об энергетических эффектах химических реакций, энтальпии химической реакции, энтропии и ее изменении при химической реакции, энергии Гиббса;
уметь: производить расчеты термодинамических функций на основе законов термодинамики и оценивать состояние системы
Теоретическая часть:
Химическая термодинамика применяет положения и законы общей термодинамики к изучению химических явлений. Развитие термохимии связано с работами русского ученого Г.И. Гесса. В 1841 г. им сформулирован закон, названный впоследствии законом Гесса: «Тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, т.е. от числа и характера промежуточных стадий». Для определения тепловых эффектов химических реакций используют закон Гесса и следствия из него. Для управления химическими процессами необходимо знать критерии самопроизвольных процессов и их движущие силы. Одной из таких сил является изменение энтальпии системы, другой – изменение ее энтропии.
Функция, объединяющая оба фактора, называется изобарно-изотермическим потенциалом, или энергией Гиббса.
Энергетика химических реакций базируется на законе сохранения энергии (I начало термодинамики): теплота Q, подведенная к системе, расходуется на увеличение внутренней энергии ∆U и на совершение работы W над внешней средой:
Q = ∆U + W
Если единственным видом работы, совершаемой системой, является работа расширения, то при изобарном процессе:
W = p∆V
Qр = ∆U + p∆V
Важную роль в химической термодинамике играет величина, называемая энтальпией химической реакции. Энтальпия (Н, кДж) – термодинамическая функция состояния системы, связанная с внутренней энергией соотношением:
H = U + рV
Изменение энтальпии ∆Н равно тепловому эффекту реакции в изобарном процессе, если единственным видом работы является работа расширения газа:
Ø если ∆Н<0, процесс экзотермический;
Ø если ∆Н>0, процесс эндотермический.
Уравнения реакций, в которых указаны тепловой эффект и условия протекания ∆Н˚298, агрегатные состояния или аллотропические модификации веществ, называют термохимическими уравнениями:
N2 (г )+ 3H2O (г) → 2NH3 (г), ∆Но298 = – 92,4 кДж
В основе расчета тепловых балансов реакций лежит одно из следствий из закона Гесса: тепловой эффект химической реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ с учетом стехиометрических коэффициентов реакций:
∆rН˚298= 
где ∆fН˚298 – изменение энтальпии реакции; приведенное к стандартным условиям;
 ,
,  – количество исходных веществ и продуктов реакции;
– количество исходных веществ и продуктов реакции;

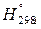 – энтальпия образования одного моля данного вещества из простых веществ, находящихся в стандартных условиях;
– энтальпия образования одного моля данного вещества из простых веществ, находящихся в стандартных условиях;
Для условной реакции аА+bB=cC+dD

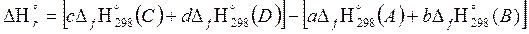
Стандартная теплота образования  – это тепловой эффект образования одного моль сложного вещества из простых веществ, устойчивых при стандартных условиях состояний.
– это тепловой эффект образования одного моль сложного вещества из простых веществ, устойчивых при стандартных условиях состояний.
Стандартные теплоты образования простых веществ принимаются равными нулю, если их агрегатные состояния и модификации устойчивы при стандартных условиях Т = 298 К, P = 101,3 кПа.
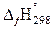 (Сграфит) = 0
(Сграфит) = 0
 (Салмаз) = 1,897 кДж/моль
(Салмаз) = 1,897 кДж/моль
Стандартные теплоты образования различных веществ указаны в таблицах термодинамических констант (приложение 3).
Энтропия (S, Дж/(К×моль)) – термодинамическая функция, количественно характеризующая вероятность того или иного состояния вещества или системы.
S = k × lnW, Дж/(К× моль)
где S – энтропия;
k – постоянная Больцмана;
W – термодинамическая вероятность.
Термодинамическая вероятность – число микросостояний, с помощью которых осуществляется данное макросостояние. Энтропия является мерой неупорядоченности системы. Изменение энтропии в системе рассчитывается также по следствию из закона Гесса:
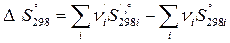

Значения стандартных энтропий веществ 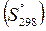 приводятся в таблицах термодинамических величин.
приводятся в таблицах термодинамических величин.
В изолированной системе необратимые процессы самопроизвольно протекают с возрастанием энтропии (II начало термодинамики).
Изменение энтропии происходит и в физических процессах, связанных с изменением агрегатного состояния. При переходе твердое вещество → жидкость → газ (пар) энтропия возрастает. Обратный переход характеризуется снижением энтропии.
Критерием самопроизвольного протекания реакций, учитывающим энтропийный и энтальпийный факторы, является энергия Гиббса (G, кДж/моль).
Изменение энергии Гиббса, ∆G, рассчитывают как сумму стандартных энергий Гиббса образования продуктов реакции за вычетом суммы стандартных энергий Гиббса исходных веществ с учетом их стехиометрических коэффициентов.


или 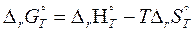
В замкнутой системе при изобарно-изотермических условиях самопроизвольно протекают реакции с уменьшением энергии Гиббса (  <0). Химическая реакция неосуществима, если энергии Гиббса в системе возрастает
<0). Химическая реакция неосуществима, если энергии Гиббса в системе возрастает 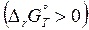 .
.
Величина  зависит от характера реакции (значений
зависит от характера реакции (значений 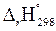 и
и 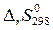 ) и от температуры. В состоянии термодинамического равновесия
) и от температуры. В состоянии термодинамического равновесия  , т.е.
, т.е. 
Температура, характеризующая состояние химического равновесия и полученная из условия  = 0, называется равновесной температурой (Тр, К) или температурой начала реакции, хотя нередко характеризует окончание процесса.
= 0, называется равновесной температурой (Тр, К) или температурой начала реакции, хотя нередко характеризует окончание процесса.

Изменение энергии Гиббса определяет направленность химических реакций:
а)  <0;
<0; 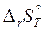 >0;
>0; 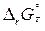 <0 при всех значениях температуры: процесс термодинамически возможен при любой температуре;
<0 при всех значениях температуры: процесс термодинамически возможен при любой температуре;
б) 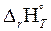 <0;
<0;  <0; в этом случае
<0; в этом случае 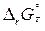 <0 при
<0 при  , т.е. реакция термодинамически возможна при сравнительно низкотемпературном режиме;
, т.е. реакция термодинамически возможна при сравнительно низкотемпературном режиме;
в) 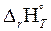 <0;
<0;  >0, тогда
>0, тогда 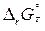 <0 при
<0 при  , следовательно процесс термодинамически возможен при сравнительно высокотемпературном режиме;
, следовательно процесс термодинамически возможен при сравнительно высокотемпературном режиме;
г) 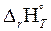 >0;
>0; 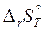 <0 – оба фактора действуют в неблагоприятном направлении, реакция термодинамически невозможна при любых значениях температуры.
<0 – оба фактора действуют в неблагоприятном направлении, реакция термодинамически невозможна при любых значениях температуры.
Практическая часть (примеры решения задач):
Задача 1: Рассчитать тепловой эффект реакции и записать для нее термохимическое уравнение
4HCl (г) + O2 (г) = 2H2O (г) + 2Cl2 (г)
Решение: Тепловой эффект реакции рассчитывается по следствию из закона Гесса, который для данной реакции будет иметь вид:

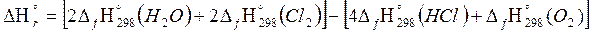
Используя приложение 3, определим необходимые для расчетов стандартные теплоты образования исходных веществ и продуктов реакции, не забывая об агрегатных состояниях.
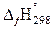 (HCl газ) = – 92,3 кДж/моль
(HCl газ) = – 92,3 кДж/моль
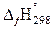 (О2 газ) = 0
(О2 газ) = 0
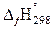 (Н2О газ) = – 241,84 кДж/моль
(Н2О газ) = – 241,84 кДж/моль
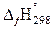 (Cl2 газ) = 0
(Cl2 газ) = 0
Подставив указанные значения в приведенную формулу, получим:
∆rН˚298 = 2 ∙ (– 241,84) – 4 ∙ (– 92,3) = – 114,48 кДж
Термохимическое уравнение реакции будет иметь вид:
4HCl (г) + O2 (г) = 2H2O (г) + 2Cl2 (г), ∆rН˚298 = – 114,48 кДж
Задача 2: Для реакции, приведенной в задании 1, рассчитать изменение энтропии.
Решение: Изменение энтропии системы рассчитывается также по следствию из закона Гесса.
Используя приложение 3, определим необходимые для расчетов абсолютные стандартные энтропии исходных веществ и продуктов реакции, не забывая об агрегатных состояниях.
 (HCl газ) = 186,7 Дж/(К∙моль)
(HCl газ) = 186,7 Дж/(К∙моль)
 (О2 газ) = 205,03 Дж/(К∙моль)
(О2 газ) = 205,03 Дж/(К∙моль)
 (Н2О газ) = 188,74 Дж/(К∙моль)
(Н2О газ) = 188,74 Дж/(К∙моль)
 (Cl2 газ) = 223,0 Дж/(К∙моль)
(Cl2 газ) = 223,0 Дж/(К∙моль)
Подставив указанные значения в приведенную формулу:

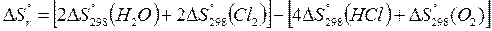
получим:
 (2 ∙ 188,74 + 2 ∙223,0) – (4 ∙ 186,7 + 205,03) = – 128,35 Дж(К∙моль)
(2 ∙ 188,74 + 2 ∙223,0) – (4 ∙ 186,7 + 205,03) = – 128,35 Дж(К∙моль)
Задача 3: Для реакции, приведенной в задании 1, рассчитать изменение энергии Гиббса, определить возможность протекания реакции в стандартных условиях и температуру начала/окончания реакции.
Решение: Изменение энергии Гиббса системы можно рассчитывается по следствию из закона Гесса на основании справочных данных (приложение 3).
Но, поскольку мы уже определили тепловой эффект реакции и изменение энтропии химической реакции, произведем расчет изменения энергии Гиббса на основании уравнения, подставив температуру 298 К, соответствующую стандартным условиям и приведя к единому значению единицы измерения используемых величин:
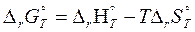
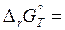 – 114,48 – 298 ∙ (– 128,35 ∙ 10–3) = – 76,23 кДж
– 114,48 – 298 ∙ (– 128,35 ∙ 10–3) = – 76,23 кДж
Поскольку полученное значения  < 0, реакция окисления хлороводорода кислородом в стандартных условиях будет протекать самопроизвольно. Поэтому, в данном случае, равновесная температура будет характеризовать окончание процесса, протекающего самопроизвольно в прямом направлении.
< 0, реакция окисления хлороводорода кислородом в стандартных условиях будет протекать самопроизвольно. Поэтому, в данном случае, равновесная температура будет характеризовать окончание процесса, протекающего самопроизвольно в прямом направлении.

Тр = – 114,48 :(– 128,35 ∙ 10–3) = 891,9 К
Контрольные вопросы:
1. Сформулируйте закон Гесса.
2. Какая величина называется энтальпией?
3. Какие значения энтальпии характеризуют эндотермический и экзотермический процессы?
4. Приведите пример термохимического уравнения реакции.
5. Как формулируется следствие из закона Гесса?
6. Какая величина называется стандартной теплотой образования вещества?
7. Что характеризует энтропия?
8. Какой критерий характеризует возможность самопроизвольного протекания реакций? Как он рассчитывается?
9. Как на основании изменения энергии Гиббса определить направленность химической реакции?
Контрольные задания:
1. Напишите термохимическое уравнение реакции между СО (г) и водородом, в результате которой образуется СН4(г) и Н2О(г). Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана при н.у.?
2. При сжигании 8 г серы с образованием оксида серы (IV) выделяется 73,85 кДж теплоты. Вычислите теплоту образования оксида серы (IV).
3. Вычислите, используя приведенные термохимические уравнения, какой минимальный объем (м3, н.у.) ацетилена требуется сжечь, чтобы полученной теплоты хватило на полное разложение 18 кг воды.
2C2H2 (г) + 5 O2 (г) = 4CO2 (г) + 2H2O (ж) DHх.р. = – 2700 кДж
2H2O (ж) = O2 (г) + 2H2 (г) DHх.р. = 572 кДж
4. Какая из протекающих в организме реакций превращения глюкозы поставляет большее количество энергии? Произведите необходимые расчеты и поясните ответ.
С6H12O6 (к) = 2С2H5OH (ж) + 2CO2 (г)
С6H12O6 (к) + 6O2 (г) = 6H2O (ж) + 6CO2 (г)
5. На основании стандартных теплот образования рассчитайте тепловой эффект реакции Fe3O4(к) + CO(г) ® FeO(к) + CO2(г) в стандартных условиях.
6. Рассчитайте для приведенной в задании 5 реакции стандартную энтропию.
7. Определите для приведенной в задании 5 реакции температуру начала реакции. Будет ли данная реакция протекать в стандартных условиях?
Рекомендуемая литература:
1. Глинка, Н.Л. Общая химия: учеб. пособие / Н. Л. Глинка; под ред. А. И. Ермакова. – М.: Интеграл-Пресс, 2009. – 728 с.
2. Коровин Н.В. Общая химия: учеб. рек. Мин. обр. РФ/ Н.В. Коровин. – М.: Высшая школа, 2009. – 558 с.
3. Глинка, Н.Л. Задачи и упражнения по общей химии: учеб. пособие: рек. Мин. обр. РФ/ Н.Л. Глинка. – Л.: Химия, 2006. – 240 с.
4. Ахметов, Н.С. Лабораторные и семинарские занятия по общей и неорганической химии: Учеб. пособие: Рек. Мин. обр. РФ / Ахметов Н.С., Азизова М.К., Бадыгина Л.И. - М.: Высш. шк., 2002. - 368с. с.
5. Тестовые задания по общей и неорганической химии с решениями и ответами: учеб. пособие / Р. А. Лидин [и др.]. – М.: БИНОМ; М.: Лаборатория знаний, 2004. – 231 с.
6. Родина, Т.А. Практикум по общей и неорганической химии: учеб. пособие/ Т.А. Родина, А.В. Иванов, В.И. Митрофанова; АмГУ, ИФФ. – Благовещенск: Изд-во Амур. гос. ун-та, 2008. – 208 с.
Дата добавления: 2015-09-11; просмотров: 2946;
