Практическое занятие 6: Способы выражения концентрации
растворов (решение задач)
Цель занятия: Формирование базовых знаний о способах определения свойств и концентраций растворов и навыков проведения расчетов.
Требования к знаниям, которые студент должен приобрести в результате освоения темы:
знать:способы выражения состава растворов;
уметь: вычислять состав и количества индивидуальных веществ в растворах
Теоретическая часть:
Растворами называют термодинамически устойчивые гомогенные смеси переменного состава, образованные из двух и более компонентов. Гомогенная система, образующая раствор, может быть твердой или жидкой. В состав каждого раствора обязательно входят растворенные вещества и растворитель. Растворителем называют компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор, либо компонент, концентрация которого выше концентрации других компонентов. Растворитель представляет собой среду, в которой равномерно распределены растворенные вещества и сохраняет свое фазовое состояние при образовании растворов. Компонент раствора, присутствующий в нем в меньшей концентрации, чем растворитель и молекулы которого равномерно распределены между молекулами растворителя, обычно определяют как растворенное вещество.
Состав раствора, в частности, содержание растворенного вещества, может выражаться различными способами. Концентрацией раствора называют содержание растворенного вещества в определенном массовом или объемном количестве раствора или растворителя. В химической практике наиболее часто используются следующие величины, выражающие содержание растворенного вещества в растворе:
Ø Массовая доля растворенного вещества (ω). Массовая доля представляет собой отношение массы растворенного вещества к массе всего раствора. Это безразмерная величина, выражаемая в долях от единицы или в процентах.
ω = 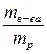 или ω =
или ω = 
где mв-ва – масса растворенного вещества, г;
mp – масса раствора, г.
Масса раствора представляет собой сумму масс растворенного вещества и растворителя:
mp = m + mр-ля
Ø Мольная доля (N) – отношение количества растворенного вещества (или растворителя) к сумме всех веществ, составляющих раствор. Также как и массовая доля, мольная доля является безразмерной величиной.
Nв-ва = 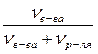
Nр-ля = 
где νв-ва – количество растворенного вещества, моль;
νp – количество вещества растворителя, моль.
Ø Молярная концентрация растворенного веществаили молярность (СМ). Молярная концентрация вещества в растворе показывает, какое количество растворенного вещества (моль) содержится в 1 литре раствора. Молярная концентрация измеряется в моль/л или моль/дм3 (М).
СМ = 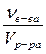 или СМ =
или СМ = 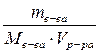
где νв-ва – количество растворенного вещества, моль;
mв-ва – масса растворенного вещества, г;
Мв-ва – молярная масса растворенного вещества, г/моль;
Vp-ра – объем раствора, л.
Ø Молярная концентрация эквивалента вещества или нормальность (Сн) – число эквивалентных масс растворенного вещества, содержащегося в 1 литре раствора; единицы измерения – моль эквивалентов/литр (н).
Сн = 
где mв-ва – масса растворенного вещества, г;
МЭ – молярная масса эквивалента вещества, г/моль.
Vp-ра – объем раствора, л;
Ø Моляльная концентрация растворенного веществаили моляльность (Сm) – величина, показывающая, какое количества растворенного вещества содержится в 1000 г растворителя. Единицы измерения моляльности – моль/кг или моль/г.
Сm =  ;
;
где mв-ва – масса растворенного вещества, г;
Мв-ва – молярная масса растворенного вещества, г/моль;
mр-ля – масса растворителя, кг.
Ø Титр растворенного вещества (Т). Титр – величина, измеряемая массой растворенного вещества (г) в 1 мл раствора.
Т = 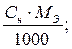 Т =
Т =  ;
;
где Сн – молярная концентрация эквивалента (нормальность);
МЭ – молярная масса эквивалента растворенного вещества, г/моль;
CМ – молярная концентрация (молярность) растворенного вещества
Мв-ва – молярная масса растворенного вещества, г/моль.
Растворы готовят не только из чистых веществ, но и из кристаллогидратов – кристаллических веществ, включающих молекулы воды. Такая вода называется кристаллизационной. Количество ее находится в простом и постоянном отношении к количеству безводного соединения. Особенно легко образуются кристаллогидраты различных солей, причем многие соли образуют несколько кристаллогидратов. Каждый кристаллогидрат устойчив в определенном интервале температур и при определенном давлении водяного пара. Примерами кристаллогидратов являются гипс CaSO4·2H2O, мирабилит Na2SO4·10H2O, квасцы KAl(SO4)2·12H2O и др. При нагревании кристаллогидраты теряют воду.
Практическая часть (примеры решения задач):
Задача 1: Вычислить массовую долю раствора серной кислоты, приготовленного из 50 г кислоты и 350 мл воды.
Решение: Массовая доля растворенного вещества в растворе определяется по формуле:
ω = 
или, в нашем случае
ω = 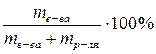
По условиям задачи растворенным веществом является серная кислота, а растворителем – вода. Для определения массы растворителя воспользуемся известной физической формулой:
m = V ∙ ρ
где m – масса вещества, г (кг);
V – объем вещества, см3 (м3);
ρ – плотность вещества, г/см3 (кг/м3)
Поскольку плотность воды ρ ≈ 1г/см3 , а по объему 1см3 = 1 мл, масса 350 мл воды составит
mр-ля = 350 ∙ 1 = 350 г
а массовая доля серной кислоты в растворе:
ω = 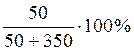 = 12,5 %
= 12,5 %
Задача 2: Вычислить молярную концентрацию раствора серной кислоты по условиям задачи 1.
Решение: Молярная концентрация растворенного вещества в растворе определяется по формуле:
СМ = 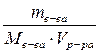
Молярная масса растворенного вещества (серной кислоты):
Мв-ва = 98 г/моль
Для проведения вычислений нам необходимо определить, какая масса серной кислоты содержится в 1 л раствора заданной концентрации. Поскольку плотность раствора не задана, ее нужно рассчитать на основании справочных данных методом интерполяции (нахождение промежуточных значений величины по имеющемуся дискретному набору известных значений). Найдем в таблице (приложение 4) для серной кислоты значения массовых долей, в интервале которых находится рассчитанное в задаче 1 значение ω = 12,5 %.
ω1 = 12,30 % ρ1 = 1085 кг/м3 = 1,085 г/см3
ω2 = 12,99 % ρ2 = 1090 кг/м3 = 1,090 г/см3
Считая, что в указанном интервале плотность раствора изменяется прямо пропорционально его концентрации, найдем разницу плотностей и соответствующую ей разницу концентраций, после чего определим поправку к плотности раствора и саму плотность.
Δω1 = 12,99 – 12,30 = 0,69 % – разница концентраций
Δρ1 = 1,090 – 1,085 = 0,005 г/см3 – разница плотностей
Δω2 = 12,50 – 12,30 = 0,29 %
Δρ2 =  =
= 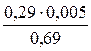 = 0,002 г/см3 – поправка к плотности раствора
= 0,002 г/см3 – поправка к плотности раствора
отсюда плотность раствора серной кислоты с массовой долей кислоты 12,5 %
ρр-ра = 1,085 + 0,002 = 1,087 г/см3
Масса 1 л 12,5 %-ного раствора будет
mр-ра = 1000 ∙ 1,087 = 1087 г
Поскольку исходный раствор с массовой долей кислоты 12,5 % содержал 50 г кислоты в 400 г раствора (задача 1), найдем массу кислоты, которая должна содержаться в 1 л (1087 г) раствора такой же концентрации. Для этого составим пропорцию, обозначив через х массу вещества в 1 л раствора (массу кислоты):
400 г раствора – 50 г кислоты
1087 г раствора – х г кислоты
х = 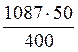 = 135,875 г
= 135,875 г
Полученное значение х представляет собой массу растворенного вещества, содержащегося в 1 л раствора (mв-ва).
СМ = 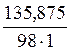 = 1,39 моль/л
= 1,39 моль/л
Задача 3: Вычислить молярную концентрацию эквивалента раствора серной кислоты по условиям задачи 1.
Решение: Молярная концентрация эквивалента определяется по формуле:
Сн = 
где молярная масса эквивалента серной кислоты
МЭ = М ∙ fЭ = 98 ∙ ½ = 49 г/моль
Массу растворенного вещества, содержащегося в 1 л раствора, мы определили в задаче 2: mв-ва = 135,785 г. Поэтому
Сн =  = 2,77 н
= 2,77 н
Задача 4: Вычислить моляльную концентрацию раствора серной кислоты по условиям задачи 1.
Решение: Моляльная концентрация растворенного вещества в растворе определяется по формуле:
Сm = 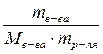 ;
;
Для решения данной задачи требуется определить, какая масса растворенного вещества содержится в 1000 г растворителя. Составим пропорцию, используя данные задачи 1 и обозначив через х массу вещества, содержащегося в 1000 г растворителя:
350 г растворителя – 50 г кислоты
1000 г растворителя – х г кислоты
х = 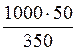 = 142,857 г
= 142,857 г
Полученное значение х представляет собой массу растворенного вещества, содержащегося в 1000 г растворителя (mв-ва).
Сm = 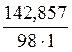 = 1,46 моль/кг
= 1,46 моль/кг
Задача 5: Вычислить объем 0,5 н раствора соляной кислоты, необходимый для полной нейтрализации 50 мл 0,1 н раствора гидроксида бария.
Решение: Согласно закону эквивалентов все вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам. Следовательно, растворы с одинаковыми молярными концентрациями эквивалентов должны взаимодействовать в равных объемах. Если же молярные концентрации эквивалентов взаимодействующих веществ различны, объемы реагирующих веществ будут обратно пропорциональны указанным концентрациям.
 =
=  откуда V1 ∙ cн1 = V2 ∙ cн2
откуда V1 ∙ cн1 = V2 ∙ cн2
Из полученного соотношения найдем необходимый объем (V2) соляной кислоты:
V2 =  =
= 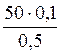 = 10 мл
= 10 мл
Задача 6: Вычислить массовую долю и молярную концентрацию раствора гидроксида калия, полученного при смешивании 700 мл 12%-ного раствора КОН с 1 л 28 %-ного раствора КОН и последующем доведении объема раствора водой до 3 литров.
Решение: Проанализируем состав полученного раствора и определим характеристики, необходимые для выполнения расчетов.
Обозначим индексом «1» все параметры, относящиеся к 12 %-ному раствору КОН, индексом «2» – к 28 %-ному раствору КОН, индексом «общ.» – к полученному раствору, параметры которого требуется определить. Поскольку в полученном растворе присутствует вода, обозначим ее объем через V3. Используя приложение 5, определим значения плотностей растворов.
V1 = 700 мл; ω1 = 12 %; ρ1 = 1,1 г/мл
V2 = 1000 мл; ω2 = 28 %; ρ2 = 1,263 г/мл
Vобщ = 3000 мл
Используя формулы
ω =  и m = V ∙ ρ
и m = V ∙ ρ
найдем массы веществ в растворах 1 и 2.
mв-ва = ω ∙ mр : 100 % = ω ∙ V ∙ ρ : 100 %
mв-ва1 = ω1 ∙ V1 ∙ ρ1 : 100 % =12 ∙700 ∙ 1,1 : 100 = 94,2 г
mв-ва2 = ω2 ∙ V2 ∙ ρ2 : 100 % =28 ∙1000 ∙ 1,263 : 100 = 353,64 г
mв-ва общ. = mв-ва1 + mв-ва2 = 94,2 + 353,64 = 447,84 г
Для определения массовой доли полученного раствора необходимо знать общую массу раствора, объем которого составляет 3. Эта величина складывается из массы раствора 1, массы раствора 2 и массы воды (300 мл).
mр общ. = mр1 + mр2 + 300 = V1 ∙ ρ1 + V2 ∙ ρ2 + 300 = 700 ∙ 1,1 +1000 ∙ 1,263 + 300
mр общ. = 2333 г
ω общ. =  =19,2 %
=19,2 %
Теперь, зная массу вещества и общий объем раствора, рассчитаем молярную концентрацию:
СМ = 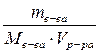
Молярная масса растворенного вещества (гидроксида калия):
Мв-ва = 56 г/моль
СМ =  = 2,67 моль/л
= 2,67 моль/л
Задача 7: Вычислить массу соли и воды, необходимую для приготовления 200 г 10 %-ного раствора сульфата никеля из кристаллогидрата NiSO4∙7H2O.
Решение: Найдем массу растворенного вещества и растворителя в 200 г 10 %-ного раствора. По аналогии с задачей 6
mв-ва = ω ∙ mр : 100 % = 10 ∙ 200 : 100 = 20 г
mр-ля = 200 – 20 = 180 г
Но для приготовления раствора используется не чистое вещество, содержащее только сульфат никеля, а его кристаллогидрат, в состав которого входит вода. Поэтому необходимо осуществить пересчет массы соли на чистое вещество. Для этого определим молярные массы чистого сульфата никеля и его кристаллогидрата:
М (NiSO4) = 154,7 г/моль
М (NiSO4∙7H2O) = 154,7 + 7 ∙ 18 = 280,7 г/моль
Таким образом, 1 моль кристаллогидрата содержит 154,7 г сульфата никеля и 126 г воды. Для определения массы соли, которую необходимо взять для приготовления заданного раствора, составим пропорцию:
154,7 г сульфата никеля (NiSO4) – 280,7 г кристаллогидрата (NiSO4∙7H2O)
20 г сульфата никеля (NiSO4) – х г кристаллогидрата (NiSO4∙7H2O)
х = 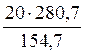 = 36,29 г
= 36,29 г
Полученное значение х представляет собой массу растворенного вещества (кристаллогидрата), которую необходимо взять для приготовления 200 г 10 %-ного раствора. Массу растворителя (воды) определим как разницу между массой раствора и массой растворенного вещества:
mр-ля = mр-ра – mв-ва = 200 – 36,29 = 163,71 г
Контрольные вопросы:
1. Что показывает концентрация раствора?
2. Как рассчитать массовую долю раствора?
3. Как рассчитать мольную долю раствора?
4. Что показывает молярная концентрация?
5. Что показывает молярная концентрация эквивалента?
6. Сравнив формулы для расчета СМ и Сн, определите фактор пересчета между ними.
7. Как определить моляльность раствора?
8. В чем заключается разница в расчете концентрации раствора, приготовленного из чистого вещества и из кристаллогидрата?
Контрольные задания:
1. В 500 г воды растворено 50 г кристаллогидрата меди CuSO4∙5H2O. Вычислите массовые доли кристаллогидрата и сульфата меди в растворе.
2. Рассчитайте, сколько граммов FeSO4∙7H2O необходимо для приготовления 2 кг 10%-ого раствора сульфата железа?
3. Рассчитайте массовую долю серной кислоты после выпаривания 50 г воды из 300 г 40 %-ного раствора серной кислоты.
4. Какова молярная концентрация эквивалента (нормальность) и какова молярность 10 %-ного раствора азотной кислоты? Плотность раствора ρ = 1,054 г/мл.
5. Чему равна массовая доля 0,2М раствора сульфата аммония c плотностью ρ = 1,015 г/мл?
6. Сколько миллилитров 70 %-ного раствора уксусной кислоты с плотностью ρ =1,0686 г/мл (уксусная эссенция) требуется для получения 500 мл 9 %-ного раствора СН3СООН, имеющего плотность ρ = 1,0112 г/мл, и 6 %-ного раствора СН3СООН (ρ = 1,0069 г/мл)? 9 %-ный и 6 %-ный растворы СН3СООН называют столовым уксусом.
7. Какова массовая доля растворенного вещества в растворе, полученном смешиванием 500 мл 10 %-ного (ρ = 1,049 г/мл) и 100 мл 38 %-ного (ρ = 1,194 г/мл) растворов соляной кислоты?
8. В каких массовых отношениях надо смешать два раствора с массовой долей 10 % и 40 %, чтобы получить раствор с массовой долей 20 %?
9. Вычислите нормальность и титр 38 %-ного раствора НСl плотностью ρ = 1,194 г/мл?
10. Сколько граммов сульфата алюминия и воды необходимо взять для приготовления 500 мл раствора с плотностью 1,226 г/мл и моляльной концентрацией 0,2 моль/кг?
Рекомендуемая литература:
1. Глинка, Н.Л. Задачи и упражнения по общей химии: учеб. пособие: рек. Мин. обр. РФ/ Н.Л. Глинка. – Л.: Химия, 2006. – 240 с.
2. Ахметов, Н.С. Лабораторные и семинарские занятия по общей и неорганической химии: Учеб. пособие: Рек. Мин. обр. РФ / Ахметов Н.С., Азизова М.К., Бадыгина Л.И. - М.: Высш. шк., 2002. - 368с. с.
3. Тестовые задания по общей и неорганической химии с решениями и ответами: учеб. пособие / Р. А. Лидин [и др.]. – М.: БИНОМ; М.: Лаборатория знаний, 2004. – 231 с.
4. Родина, Т.А. Практикум по общей и неорганической химии: учеб. пособие/ Т.А. Родина, А.В. Иванов, В.И. Митрофанова; АмГУ, ИФФ. – Благовещенск: Изд-во Амур. гос. ун-та, 2008. – 208 с.
Практическое занятие 7: Растворы неэлектролитов и электролитов (решение задач)
Цель занятия: Изучение общих закономерностей протекания химических процессов в растворах. Формирование, расширение и углубление базовых знаний о свойствах растворов электролитов и неэлектролитов.
Требования к знаниям, которые студент должен приобрести в результате освоения темы:
знать:общие свойства и особенности поведения растворов; положения теории электролитической диссоциации электролитов и гидролиза солей;
уметь: производить расчеты на основе общих свойств растворов; составлять молекулярно-ионные уравнения диссоциации и гидролиза и определять реакцию среды.
Теоретическая часть:
Процессы растворения кристаллических веществ сопровождаются поглощением теплоты, но в ряде случаев при растворении происходит повышение температуры. Теплотой растворения вещества называется количество теплоты, поглощающейся или выделяющейся при растворении 1 моля данного вещества. Процесс растворения характеризуется повышением энтропии системы, в результате чего наблюдается уменьшение энергии Гиббса (ΔG < 0), то есть процесс растворения протекает самопроизвольно.
При растворении веществ наблюдается изменение физических характеристик растворов. Законы Рауля и Вант-Гоффа отражают изменение свойств растворов.
К общим свойствам растворов относятся свойства, не зависящие от концентрации растворов и природы реагирующих веществ. Такие свойства называются коллигативными и проявляются у растворов нелетучих веществ, т.е. веществ, давлением пара которых можно пренебречь. К коллигативным свойствам относятся:
Ø Понижение давления насыщенного пара растворителя над раствором.
Ø Понижение температуры кристаллизации.
Ø Повышение температуры кипения.
Ø Осмотическое давление.
Если налить жидкость в открытый сосуд, она будет испаряться. Процесс испарения можно упрощенно представить следующим образом. Молекулы жидкости непрерывно двигаются. Те молекулы, которые расположены во внутренних слоях, взаимодействуют друг с другом и перемещаются хаотически. Для молекул, находящихся в поверхностном слое, более существенным оказывается взаимодействие с молекулами воздуха. Одновременно происходят два процесса диффузии воздуха в поверхностные слои жидкости и диффузия молекул жидкости в воздух. При невысоких температурах последний процесс практически невозможен, поскольку кинетическая энергия молекул жидкости недостаточна. Только незначительное количество молекул, обладающих необходимой кинетической энергией при данной температуре, может перейти в воздух, образуя над поверхностью жидкости пар (паровую фазу). Такой процесс перехода жидкости с ее свободной поверхности в паровую фазу называется испарением. Этот процесс обратим. Обратным к нему является процесс конденсации. При данной температуре между жидкостью и паром может установиться равновесие, характеристикой которого будет количество испарившихся молекул жидкости, равное количеству конденсирующихся молекул пара.
Если сосуд открытый, молекулы испарившейся жидкости за счет конвективных потоков и броуновского движения уходят в окружающее пространство, а на их место приходят новые молекулы, образуя над поверхностью жидкости ненасыщенный пар. При повышении температуры количество испарившихся молекул над поверхностью жидкости увеличивается – следовательно, возрастает их концентрация. Пар становится насыщенным. Для насыщенного пара его давление является важнейшей характеристикой равновесного состояния.
Введем в данную систему нелетучее вещество в небольшом количестве. Нелетучим может считаться вещество, у которого температура кипения или давление пара значительно ниже аналогичных параметров исходного вещества. Полученную систему можно рассматривать как раствор, где исходная жидкость будет растворителем, а введенное вещество – растворенным веществом. Равновесие нарушится, поскольку введенное вещество будет содержаться только в жидкости, причем некоторые молекулы жидкости будут образовывать с молекулами растворителя сольваты (гидраты), что приведет к уменьшению молекул растворителя. В соответствии с принципом Ле Шателье усилится конденсация пара (необходимо увеличение молекул растворителя в растворе). Результатом такого процесса будет новое равновесное состояние, отличающееся от первоначального более низким давлением. Можно говорить о том, что давление насыщенного пара над чистым растворителем выше, чем давление пара над раствором. Разница между этими двумя показателями, отнесенная к давлению пара над чистым растворителем, называется относительным понижением давления пара над раствором (Dр):
Dр = (р0 – р) / р0
где р0– давление пара над чистым растворителем;
р–давление пара над раствором.
Чем больше вещества мы будем вводить в систему, тем ниже будет давление насыщенного пара. Зависимость между понижением давления пара над разбавленными растворами неэлектролитов и их концентрацией была установлена французским физиком Ф. Раулем (1887 г.) и носит название закона Рауля: относительное понижение давления насыщенного пара чистого растворителя над раствором равно мольной доле растворенного вещества (N2).
(р0 – р) / р0 = N2 ;
(р0 – р) = р0 ∙ N2
Важной физической характеристикой любого вещества является температура его кипения. Для чистой жидкости температурой кипения называется температура, при которой давление ее паров равно внешнему давлению. Температуру кипения растворов так определять нельзя. Это объясняется тем, что понижение давления пара в результате растворения вызывает необходимость повышения температуры выше точки кипения для того, чтобы давление насыщенного пара над раствором стало равно давлению насыщенного пара над чистым растворителем. Кипение начинается только в этот момент. Следовательно, температура кипения раствора нелетучего вещества выше температуры кипения чистого растворителя. Разность между этими двумя температурами называется повышением температуры кипения раствора (Dtкип).
Если рассматривать процесс кристаллизации, мы обнаружим, что при температуре кристаллизации давление насыщенного пара над чистым растворителем ниже, чем над раствором. Поэтому добиться кристаллизации раствора можно только при охлаждении его до температуры, при которой давления насыщенного пара над жидкой и твердой фазами будут равны между собой. Следовательно, температура кристаллизации чистого растворителя будет выше, чем температура кристаллизации раствора. Разность между этими двумя температурами называется понижением температуры кристаллизации раствора (Dtкрист).
Зависимость Dtкип и Dtкрист от концентрации носит название второго закона Рауля: повышение температуры кипения (понижение температуры кристаллизации) разбавленных растворов неэлектролитов пропорционально числу частиц растворенного вещества и не зависит от его природы.
Dtкип = E · Cm;
Dtкрист = K · Cm
Коэффициенты пропорциональности в обоих уравнениях называются эбуллиоскопической (Е) и криоскопической (К) константами, Cm – моляльная концентрация. Второй закон Рауля часто называют следствием из первого закона.
Для растворов неэлектролитов справедливы следующие зависимости:
Dtкип = tкип.р-ра – tкип.р-ля;
Dtкрист = tкрист.р-ля – tкрист.р-ра
где tкип.р-ра и tкип.р-ля – температуры кипения раствора и растворителя, соответственно;
tкрист.р-ля и tкрист.р-ра– температуры кристаллизации растворителя и раствора, соответственно.
Теперь рассмотрим еще один процесс, характеризующий общие свойства растворов – осмос, или явление селективной диффузии частиц через полупроницаемую мембрану. Возьмем кювету с водой, разделенную непроницаемой перегородкой, и поместим в одну часть кюветы некоторое количество глюкозы. В результате растворения половина раствора станет сладкой, а через некоторое время после того, как мы осторожно уберем перегородку, за счет диффузии произойдет выравнивание концентрации глюкозы в обеих частях кюветы и раствор станет однородным. Процесс диффузии в данном случае будет двусторонним как за счет частиц растворителя, так и за счет частиц растворенного вещества. Такие произвольные процессы диффузии можно наблюдать достаточно часто.
Если мы повторим опыт, поставив вместо перегородки полупроницаемую, гибкую и упругую мембрану, пропускающую растворитель, но не пропускающую растворенное вещество, наблюдаемые через некоторое время изменения в растворе будут отличаться от первого опыта. Вместо выравнивания концентрации мы обнаружим разбавление раствора в одной части кюветы. Объем раствора этой части кюветы увеличится за счет диффузии молекул воды (растворителя) через перегородку (мембрана выгибается в одну сторону). То есть, наблюдаемая диффузия будет односторонней. Такой процесс и называется осмосом, а избыточное давление, выгибающее мембрану, – осмотическим давлением.
Исследования показывают, что осмотическое давление в разбавленных растворах неэлектролитов не зависит от природы компонентов раствора, но возрастает пропорционально молярной концентрации растворенного вещества и абсолютной температуре раствора.
Pосм = R ∙ T ∙ CM
где Pосм – осмотическое давление раствора, кПа;
CM– молярная концентрация раствора, моль/л;
R– универсальная газовая постоянная;
T– абсолютная температура, К.
Если в приведенном выше уравнении вместо CM записать ее выражение через количество вещества в единице объема (см. занятие 6), получим:
Pосм = R ∙ T ∙ 
Pосм ∙ V = R ∙ T ∙ 
Впервые это уравнение было предложено Вант-Гоффом в 1886 г. Закон Вант-Гоффа формулируется следующим образом: в разбавленных растворах неэлектролитов осмотическое давление равно тому давлению, которое оказывало бы растворенное вещество, если бы оно было газом и при той же температуре занимало бы тот же объем, который занимает раствор.
Важной характеристикой веществ является электропроводность, то есть способность вещества (тела) пропускать электрической ток под действием электрического поля, обусловленная наличием большого количества способных свободно перемещаться зарядов. С этих позиций все химические вещества можно разделить на вещества, проводящие ток, и вещества, ток не проводящие. Такая способность обусловлена свойствами веществ. Вещества, которые при растворении или расплавлении распадающиеся на ионы, способные под действием внешнего поля к направленному движению, называются электролитами. Поскольку прохождение тока в электролитах связано с химическими процессами и обусловлено движением положительных и отрицательных ионов, они являются проводниками II рода. Вещества, которые не способны при растворении и расплавлении распадаться на ионы (следовательно, проводить электрический ток), называются неэлектролитами.
Процесс распада электролитов на ионы при растворении их в воде называется элекролитической диссоциацией. Причиной диссоциации является взаимодействие электролитов с полярными молекулами растворителя. Теория электролитической диссоциации (ТЭД) была предложена С. Аррениусом (1887 г.) и, по мере формирования и углубления химических представлений о строении атома и химической связи, получила развитие в трудах многих ученых. В основе ТЭД лежат следующие положения:
Ø При растворении в воде электролиты диссоциируют (распадаются) на положительные (катионы) и отрицательные (анионы) ионы. Названия ионов обусловлены тем, что под действием электрического тока положительно заряженные ионы движутся к катоду, отрицательно заряженные – к аноду.
Ø Для ионов характерны более устойчивые электронные состояния, чем для атомов.
Ø Ионы могут быть простыми (состоят из одного атома: Na+, Mg2+, Аl3+ и т.д.) и сложными (состоят из нескольких атомов: NО3-, SO2-4, РОЗ-4 и т.д.).
Ø Диссоциация является обратимым процессом. Обратный процесс – ассоциация, то есть образование из противоположно заряженных ионов, находящихся в растворах электролитов частиц, в которых ионы удерживаются за счет электростатического взаимодействия их электрических зарядов в соответствии с законом Кулона.
К электролитам относятся кислоты, основания и практически все соли, к неэлектролитам – большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Количественными характеристиками процесса диссоциации являются степень диссоциации и константа диссоциации. Степень диссоциации электролита (α) показывает отношение молекул, распавшихся в данном растворе на ионы (Nдис.) к общему количеству молекул электролита (Nобщ.). Степень диссоциации измеряется в долях или процентах. На величину α влияют следующие факторы:
Ø природа растворенного вещества;
Ø среда растворителя: степень диссоциации увеличивается с увеличением полярности растворителя;
Ø концентрация раствора;
Ø температура. Так как диссоциация относится к эндотермическим процессам, повышение температуры увеличивает степень диссоциации.
По величине степени диссоциации электролиты разделяют на сильные и слабые. Сильными электролитами являются вещества с ионной, сильно поляризованной связью. К ним относятся практически все соли (исключение составляют некоторые соли ртути, кадмия, железа и др.), основания металлов первой и второй групп главных подгрупп (исключение составляют Be(OH)2, Mg(OH)2) и следующие кислоты: HCl, HBr, HI, HNO3, H2SO4, HClO4, HMnO4 и H2Cr2O7. Две последние кислоты в свободном состоянии неустойчивы.
Для характеристики слабых электролитов помимо степени диссоциации используют константу диссоциации (С – концентрация электролита):
Кдис. = 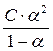
Диссоциация многоосновных кислот и многокислотных оснований происходит ступенчато (см. практическую часть); соли диссоциируют нацело на первой ступени. Диссоциация слабых электролитов протекает преимущественно по первой ступени.
С позиций ТЭД дают определения и описывают свойства представителей основных классов неорганических соединений, за исключением оксидов, которые не диссоциируют. Кислотой является вещество, при диссоциации которого в качестве катионов образуются исключительно катионы водорода Н+. Если при диссоциации соединения в качестве анионов образуются только анионы гидроксогрупп ОН–, такое соединение называется основанием. При диссоциации солей образуются катионы металлов (и катион аммония) и анионы кислотных остатков.
Все реакции в водных растворах электролитов, согласно ТЭД, представляют собой реакции между ионами и называются ионными реакциями. Уравнения таких реакций называют ионными уравнениями. Они проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер. При составлении ионных уравнений используют следующие правила:
Ø газообразные, малорастворимые (осадок) и малодиссоциирующие вещества записываются в молекулярной форме.
Ø для указания, что вещество уходит из зоны реакции в виде осадка, после формулы вещества ставится знак ↓;
Ø для указания, что вещество уходит из зоны реакции в виде газа, после формулы вещества ставится знак ↑;
Ø сильные электролиты, как полностью диссоциированные, записывают в виде ионов;
Ø сумма электрических зарядов левой части уравнения должна быть равна сумме электрических зарядов правой части.
К необратимым ионообменным реакциям относятся процессы, в которых хотя бы одно из веществ не диссоциирует, либо диссоциирует крайне слабо. Признаками необратимости ионнообменных реакций (правило Бертолле) являются:
Ø образование малодиссоциируемого электролита;
Ø образование нерастворимого осадка;
Ø образование газообразного вещества;
Ø образование воды.
Процесс обменного взаимодействия ионов солей с молекулами воды, в результате которого образуются кислота (или кислая соль), и основание (или основная соль), называется гидролизом солей. В процессе гидролиза среда раствора практически всегда изменяется. Гидролиз относится к обратимым процессам, обратный процесс представляет собой реакцию нейтрализации – взаимодействие основания и кислоты, в результате которого образуются соль и вода. Гидролиз является эндотермическим процессом. Действие электростатического поля ионов приводит к поляризации молекул вода, что увеличивает степень ее диссоциации.
Различают следующие механизмы гидролиза:
Ø катионный механизм реализуется в том случае, когда катион обладает сильным поляризующим действием (катион слабого основания). В этом случае происходит взаимодействие катионов с молекулами воды по донорно-акцепторному механизму, где акцептором является катион, имеющий свободные атомные орбитали, а донором – атом кислорода (две неподеленные электронные пары) в составе молекулы воды.
 КА ⇄ К+ + А–
КА ⇄ К+ + А–
 ··
··

 H:О:Н + К+ → К : ОH + Н+
H:О:Н + К+ → К : ОH + Н+
··
Присутствие в растворе катионов водорода определяет реакцию среды: среда кислая, рН < 7.
Ø анионный механизм реализуется в том случае, когда анион обладает сильной поляризуемостью (анион слабой кислоты). В этом случае происходит отрыв водорода от молекулы воды:
КА ⇄ К+ + А–


 ··
··


 А– + Нδ+→:Оδ–Н Н : А + ОН–
А– + Нδ+→:Оδ–Н Н : А + ОН–
Присутствие в растворе ионов ОН– определяет реакцию среды: среда щелочная, рН > 7.
Ø катионно-анионный механизм реализуется в том случае, когда катион в составе соли обладает сильным поляризующим действием (катион слабого основания), а анион – сильной поляризуемостью (анион слабой кислоты). В этом случае среда нейтральная:

 К+ + А:– + 2Н–ОН НА + КОН + Н2О
К+ + А:– + 2Н–ОН НА + КОН + Н2О
В зависимости от состава соли выделяют несколько типов гидролиза:
Ø Соли сильного основания и сильной кислоты при растворении в воде не гидролизуются, и раствор соли имеет нейтральную реакцию.
Ø Соли сильного основания и cлабой кислоты в водном растворе в качестве одного из продуктов реакции образуют слабый электролит (кислоту) и раствор приобретает щелочную реакцию.
Ø Соли слабого основания и сильной кислоты в водном растворе в качестве одного из продуктов реакции образуют слабый электролит (основание) и раствор приобретает кислую реакцию.
Ø Соли слабого основания и слабой кислоты при растворении в воде образуют малодиссоциирующие кислоту и основание. Реакция среды в растворах подобных солей зависит от относительной силы кислоты и основания. Другими словами, водные растворы таких солей могут иметь нейтральную, слабокислую или слабощелочную реакцию в зависимости от констант диссоциации образующихся кислот и оснований.
Практическая часть (примеры решения задач):
Задача 1: Определить температуру кипения и температуру кристаллизации водного раствора глюкозы, полученного при растворении 25 г глюкозы в 200 г воды.
Решение: В данном растворе глюкоза является растворенным веществом, а вода – растворителем. Для определения температуры кипения и температуры кристаллизации воспользуемся вторым законом Рауля:
Dtкип = E · Cm;
Dtкрист = K · Cm
Dtкип = tкип.р-ра – tкип.р-ля;
Dtкрист = tкрист.р-ля – tкрист.р-ра
Для расчета повышения температуры кипения и понижения температуры кристаллизации необходимо рассчитать моляльность раствора (пример расчета моляльной концентрации приведен в задаче 4 практического занятия 6). Для определения массы вещества, содержащегося в 1000 г растворителя, составим пропорцию, учитывая условия задачи:
25 г растворенного вещества (глюкозы) – 200 г растворителя (воды)
х г растворенного вещества (глюкозы) – 1000 г растворителя (воды)
х = 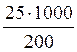 = 125 г
= 125 г
Молярная масса глюкозы М(С6Н12О6) = 180 г/моль. Моляльная концентрация раствора глюкозы, содержащего 125 г растворенного вещества в 1 кг растворителя:
Сm = 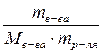 ;
;
Сm = 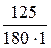 = 0,694 г/кг
= 0,694 г/кг
Для расчета Dtкип и Dtкрист воспользуемся справочными данными (приложение 7). Для воды, которая в исследуемом растворе используется в качестве растворителя:
tкип.р-ля = 100 0С Е = 0,52 tкрист.р-ля = 0 0С К = 1,85
Dtкип = 0,52 · 0,694 = 0,36 0С;
Dtкрист = 1,85 · 0,694 = 1,28 0С;
tкип.р-ра = tкип.р-ля + Dtкип = 100 + 0,36 = 100,36 0С;
tкрист.р-ра = tкрист.р-ля – Dtкрист = 0 – 1,28 = –1,28 0С.
Задача 2: Определить давление насыщенного пара над раствором нафталина в бензоле, если в раствор получен из 12,8 г нафталина и 83 г бензола, а давление насыщенного пара бензола при 20 0С 100 кПа.
Решение: Согласно первому закону Рауля, понижение давления пара растворителя над раствором выражается зависимостью:
(р0 – р) / р0 = N2
Отсюда
Δp = p0 – p = p0 · N2 = p0 ∙ 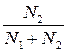
где N1 и N2 – мольные доли растворителя и растворенного вещества в растворе, соответственно.
Мольные доли растворенного вещества и растворителя находятся из соотношений (см. практическое занятие 6):
Nв-ва = 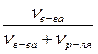
Nр-ля = 
Подставляя эти выражения в приведенное выше уравнение для Δр, получим:
Δp = p0 ∙ 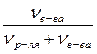
Количества вещества находится по формуле:
ν = m/ M;
Количества растворенного вещества (нафталин, С10Н8, М = 128 г/моль) и растворителя (бензол, С6Н6, М = 78 г/моль):
νв-ва = mв-ва / Mв-ва = 12,8 : 128 = 0,1 моль;
νр-ля = mр-ля / Mр-ля = 83 : 78 = 1,06 моль
Δp = 100∙  = 8,6 кПа
= 8,6 кПа
Давление пара над раствором составит:
р = р0 – Δр = 100 – 8,6 = 91,4 кПа
Задача 3: Какое из веществ – нитрат натрия или сульфат натрия – будет взаимодействовать в растворе с хлоридом бария. Составьте молекулярные и ионно-молекулярные уравнения указанных реакций.
Решение: Согласно правилу Бертолле реакция обмена протекает в том случае, когда ее продуктами является малорастворимое соединение (осадок), легколетучее вещество (газ), или малодиссоциирующее соединение (очень слабый электролит, в том числе и вода).
Запишем уравнения реакций взаимодействия указанных веществ и воспользуемся таблицей растворимости (приложение 2):
2NaNO3 + BaCl2 = Ba(NO3)2 + 2NaCl
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
В первой реакции образуются две соли – нитрат бария и хлорид натрия, которые являются сильными электролитами и растворимы. Поэтому, согласно правилу Бертолле, данная реакция в растворе не протекает. В процессе взаимодействия между сульфатом натрия и хлоридом бария образуется осадок BaSO4, вещество, которое нерастворимо ни в воде, ни в кислотах. Следовательно, протекание такой реакции в растворе возможно.
Для второй реакции составим уравнение в ионно-молекулярном виде, учитывая, что сильные растворимые электролиты записывают в виде ионов:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
2Na+ + SO42– + Ba2+ + 2Cl– = BaSO4↓ + 2Na+ + 2Cl–
Исключив одинаковые ионы из левой и правой частей, получим сокращенное ионное уравнение реакции:
SO42– + Ba2+ = BaSO4↓
согласно которому сущность реакции сводится к взаимодействию катионов бария и сульфат-анионов.
Задача 4: Составить молекулярное уравнение реакции, которое выражается ионно-молекулярным уравнением:
СО32– + 2Н+ = СО2 + Н2О
Решение: Левая часть данного уравнения показывает, что исходными веществами реакции являются сильные электролиты, причем – растворимые соединения. Так как в левой части один из ионов – ион водорода Н+, в реакции участвовала сильная одноосновная кислота. Используя таблицу растворимости (приложение 2), убедимся, что растворимые карбонаты образуют только катионы щелочных металлов и катион аммония. Поэтому выберем в качестве исходной соли карбонат калия и соляную кислоту. Для подтверждения правильности решения запишем не только молекулярное, но и ионно-молекулярное уравнение реакции:
К2СО3 + 2НCl = 2KCl + Н2СО2 + Н2О
Н2СО2 = СО2↑ + Н2О
2K+ + СО32– + 2Н+ + 2Cl– = 2K+ + 2Cl– + СО2↑ + Н2О
СО32– + 2Н+ = СО2↑ + Н2О
Полученное сокращенное ионное уравнение подтверждает правильность выбора.
Задача 5: Составить молекулярное и ионно-молекулярное уравнения гидролиза сульфида калия, определить среду раствора и указать факторы, усиливающие гидролиз данной соли.
Решение: Сульфид калия K2S является солью сильного основания (КОН) и слабой двухосновной кислоты (Н2S). При растворении данной соли в воде реализуется анионный механизм гидролиза: анион слабой кислоты, обладающий сильной поляризуемостью, будет отрывать катион водорода от молекулы воды. Катионы калия, не обладающие сильным поляризующим действием, в растворе не будут взаимодействовать с анионами гироксогрупп. Поскольку кислота двухосновная, гидролиз преимущественно будет происходить по первой ступени, так как анионы HS– (Кд = 3,63·10–12) диссоциируют слабее, чем молекулы Н2S по первой ступени (Кд = 1,1·10–7). Константы диссоциации слабых электролитов приведены в приложении 6.
K2S + НОН ⇄ КОН + КHS
или, в ионно-молекулярном виде:
2K+ + S2– + НОН ⇄ К+ + ОН– + К+ + HS–
S2– + НОН ⇄ ОН– + HS–
Так как в растворе присутствуют ионы ОН–, среда щелочная, рН > 7.
Согласно принципу Ле Шателье повышение температуры приводит к смещению равновесия в сторону эндотермического процесса, а поскольку гидролиз – процесс эндотермический, при повышении температуры он усилится. К усилению гидролиза приведет и разбавление раствора, а также добавление вещества, при диссоциации которого образуются ионы водорода Н+. Данные ионы будут связываться с ионами ОН–, что приведет к образованию молекул воды (разбавление раствора).
Контрольные вопросы:
1. Какой процесс называется растворением, в чем заключается его механизм?
2. Какие свойства растворов называются коллигативными? Охарактеризуйте эти свойства и приведите закономерности, их описывающие.
3. Как происходят процессы испарения, конденсации?
4. Какой процесс называется осмосом?
5. В чем заключается разница в физических свойствах растворов и чистых растворителей?
6. Сформулируйте законы Рауля и Вант-Гоффа.
7. В чем состоит разница между электролитами и неэлектролитами? Приведите примеры.
8. Сформулируйте основные положения ТЭД.
9. Как количественно характеризуют растворы электролитов?
10. По каким признакам электролиты разделяют на сильные и слабые. Приведите примеры. Какие факторы влияют на процессы диссоциации сильных и слабых электролитов?
11. Дайте определение кислотам, основаниям и солям в свете теории электролитической диссоциации.
12. Как диссоциируют многоосновные кислоты?
13. В чем разница между процессами диссоциации серной и сернистой кислот?
14. Как составляются ионно-молекулярные уравнения реакций? Приведите примеры.
15. Сформулируйте правило Бертолле и приведите уравнения реакций, отражающих его содержание.
16. Какой процесс называется гидролизом солей?
17. Опишите механизмы, характерные для процесса гидролиза. Приведите примеры.
18. Приведите классификацию солей, участвующих в процессах гидролиза. Приведите примеры для каждого типа.
19. Какие факторы влияют на гидролиз?
Контрольные задания:
1. Рассчитайте температуру кипения и кристаллизации раствора 5-ного раствора анилина в бензоле.
2. Раствор получен из неэлектролита с молярной массой 340 г/моль, растворенного в 250 г воды. Определите массу вещества в растворе, если температура замерзания –0,28 0С.
3. Определите молярную массу вещества, полученного при растворении 2,3 г вещества в 100 г воды, если температура кипения данного раствора 100,26 0С.
4. Запишите молекулярные и ионно-молекулярные уравнения процессов взаимодействия между растворами соляной кислоты и карбоната калия, гидроксида натрия и азотной кислоты, хлорида бария и нитрата серебра, сульфида натрия и нитрата свинца, гидроксида бария и соляной кислоты. Растворы каких из перечисленных пар будут взаимодействовать между собой?
5. Запишите уравнения, характеризующие процессы гидролиза хлорида бериллия, нитрата меди, сульфида аммония. Для каждой соли определите реакцию среды раствора, факторы, усиливающие и ослабляющие гидролиз.
6. Из приведенного перечня выберите соли, значения рН водного раствора которых будет меньше 7: нитрат натрия, карбонат калия, сульфат железа (II), сульфид аммония
Рекомендуемая литература:
1. Глинка, Н.Л. Общая химия: учеб. пособие / Н. Л. Глинка; под ред. А. И. Ермакова. – М.: Интеграл-Пресс, 2009. – 728 с.
2. Глинка, Н.Л. Задачи и упражнения по общей химии: учеб. пособие: рек. Мин. обр. РФ/ Н.Л. Глинка. – Л.: Химия, 2006. – 240 с.
3. Ахметов, Н.С. Лабораторные и семинарские занятия по общей и неорганической химии: Учеб. пособие: Рек. Мин. обр. РФ / Ахметов Н.С., Азизова М.К., Бадыгина Л.И. - М.: Высш. шк., 2002. - 368с. с.
4. Тестовые задания по общей и неорганической химии с решениями и ответами: учеб. пособие / Р. А. Лидин [и др.]. – М.: БИНОМ; М.: Лаборатория знаний, 2004. – 231 с.
5. Родина, Т.А. Практикум по общей и неорганической химии: учеб. пособие/ Т.А. Родина, А.В. Иванов, В.И. Митрофанова; АмГУ, ИФФ. – Благовещенск: Изд-во Амур. гос. ун-та, 2008. – 208 с.
Дата добавления: 2015-09-11; просмотров: 89535;
