Аналитические способы выражения концентрации растворов.
Моляльная концентрация (моляльность) – величина, показывающая, сколько молей растворенного вещества в растворе приходится на 1 кг растворителя:
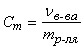 (моль/кг)
(моль/кг)
где Vв-ва – количество растворенного вещества в растворе, моль; mр-ля – масса растворителя в растворе, кг.
Титр – величина, показывающая, какая масса растворенного вещества содержится в 1 мл раствора:
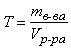 (г/мл)
(г/мл)
где mв-ва – масса растворенного вещества в растворе, г; Vр-ра – объем раствора, мл.
Мольная доля вещества в растворе представляет собой отношение числа молей этого вещества к суммарному количеству молей всех компонентов раствора:
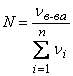 ,
,
где Vв-ва – число молей компонента, для которого определяется мольная доля; n – количество компонентов раствора.
Количественный состав раствора чаще всего выражается с помощью понятия «концентрации», под которым понимается содержание растворенного вещества (в определенных единицах) в единице массы или объема.
Договорились растворенное вещество обозначать через X, а растворитель - через S.
Чаще всего для выражения состава раствора используют массовую долю, молярную концентрацию (молярность) и мольную долю.
Массовая доля - это отношение массы растворенного вещества к общей массе раствора. Для бинарного раствора:
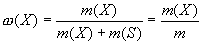 (1)
(1)
где ω(Х) - массовая доля растворенного вещества X; m(Х) масса растворенного вещества X, г; m(S) - масса растворителя S, г; m= [m(Х) + m(S)] - масса раствора, г.
Массовую долю выражают в долях единицы или в процентах (например: ω = 0,01 или ω = 1%).
Молярная концентрация (молярность) показывает число молей растворенного вещества, содержащегося в 1 литре раствора:
С(Х) = v(Х) / V, (2)
где С(Х) - молярная концентрация растворенного вещества X, моль/л; v(Х) - количество растворенного вещества X, моль; V - объем раствора, л.
Как следует из (2), молярная концентрация выражается в моль/л. Эта размерность иногда обозначается М, например: 2МNаОН.
Мольная доля растворенного вещества - безразмерная величина, равная отношению количества растворенного вещества к общему количеству веществ в растворе:
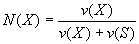 (3)
(3)
где N(Х) - мольная доля растворенного вещества X; v(Х) - количество растворенного вещества X, моль; v(S) - количество вещества растворителя S, моль.
Нетрудно представить, что сумма мольных долей растворенного вещества и растворителя равна 1:
N(X) + N(S) = 1. (4)
При решении многих задач полезно переходить от молярной концентрации к массовой доле, мольной доле и т.д. Например, молярная и процентная концентрации взаимосвязаны так:
C(X) = 10 ∙ ω(X) ∙ ρ / M(X), (5)
ω(X) = C(X) ∙ M(X) / (10 ∙ ρ) (6)
где ω(Х) - массовая доля растворенного вещества, выраженная в %; М(Х) - молярная масса растворенного вещества, г/моль; р = m/(1000 V) - плотность раствора, г/мл.
Очень часто концентрацию насыщенного раствора, наряду с вышеперечисленными характеристиками, выражают через так называемый коэффициент растворимости или просто растворимость вещества.
Отношение массы вещества, образующего насыщенный раствор при данной температуре, к массе растворителя называют коэффициентом растворимости:
ks = mв-ва / mр-ля . (7)
Растворимость вещества s показывает максимальную массу вещества, которая может раствориться в 100 г растворителя:
s = (mв-ва / mр-ля) ∙ 100. (8)
5. Расчётные формулы и техника приготовления растворов кислот, солей и щелочей технических и аналитических концентраций.
Задача 1. В лаборатории имеется раствор с массовой долей гидроксида натрия 25%, плотность которого равна 1,27 г/мл. Рассчитайте его объём, который надо смешать с водой, чтобы получить 500 мл раствора с массовой долей NаОН 8% (плотность 1,09 г/мл).
Решение. Будем обозначать величины, относящиеся к исходному раствору, индексом “1” (например, m1 – масса исходного раствора); величины, относящиеся к раствору, который надо приготовить, - индексом “2” (m2 – масса раствора, который надо приготовить); величины, одинаковые для обоих растворов, индекса иметь не будут.
1. Рассчитываем массу раствора NaOH, который требуется приготовить:
m2 = V2 · ρ2; m2 = 500 . 1,09 г = 545 г.
2. Определяем массу NaOH, которая будет содержаться в растворе (такая же масса гидроксида натрия должна содержаться и в исходном растворе, которая будет разбавлена водой):
Вычисляем массу раствора с ω1(NaOH) = 25%, в котором содержится гидроксид натрия массой 43,6 г:
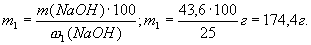
3. Рассчитываем объём исходного раствора NaOH, который надо разбавить водой:
V1 = 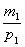 ; V1 =
; V1 = 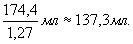
Ответ: объём гидроксида натрия 137,3 мл.
Задача 2. Реакция протекает по уравнению ЗВа2+ + 2РО43- = Ва3(РO4)2↓
Напишите два разных уравнения в молекулярной форме, соответствующих этой реакции.
Решение. К ионам в левой части исходного уравнения допишем ионы с противоположным значением заряда с таким коэффициентом, чтобы можно было составить формулы веществ. При этом учитываем,что исходные вещества должны быть достаточно хорошо растворимы в воде. Затем те же ионы с теми же коэффициентами пишем в правой части уравнения:
3Ва2++ 2РО43- = Ва3(РО4)2↓
6Cl- + 6Н+ = 6Сl- + 6Н+
Объединяя ионы обоих равенств в молекулы, получим уравнение реакции в молекулярной форме:
3ВаСl2 + 2Н3РО4 = Ва3(РО4)↓ + 6НСl
Аналогично подбираем и другие подходящие ионы:
3Ва2+ + 2РО43- = Ва3(РО4)2↓
6NO3- + 6Na+ = 6NО3- + 6Na+
Получаем второе уравнение в молекулярной форме:
3Ba(NO3)2 + 2Nа3РО4 = Ва3(РО4)2↓+ 6NaNO3
Задача 3. Принимая, что серная кислота диссоциирует полностью, определите рН её 0,012 М раствора.
Решение. Запишем уравнение полной диссоциации серной кислоты на ионы:
H2SO4  2H+ + SO42-
2H+ + SO42-
Как видим, из 1 моль кислоты образуется 2 моль Н+. Соответственно из 0,012 моль кислоты образуется 0,024 моль Н+. Концентрация ионов водорода в растворе будет равна 0,024 моль/л.
Отсюда рН = -lg[Н+]; рН = -lg 0,024 = 1,62.
Задача 4. Какое количество бария нужно взять, чтобы при его взаимодействии с 1л воды образовался 2%-ный раствор гидроксида бария?
Решение. Барий растворяется в воде по уравнению
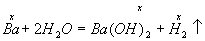
Пусть в реакцию вступило х моль Ва, тогда образовалось по x моль Ва(ОН)2 (М=171) и Н2. Масса вещества Ва(ОН)2 в растворе составляет 171x, а масса раствора равна:
m(р-ра) = 1000 + m(Ba) - m(Н2) = 1000 +137x – 2x = 1000+135x.
Массовая доля гидроксида бария равна:
ω(Ва(ОН)2) =171x / (1000 +135x) = 0,02.
oткуда х = 0,119.
Ответ. 0,119 моль Ва.
Задача 5. Рассчитайте массовые доли веществ в растворе, образовавшемся при действии 25 мл 20%-ной соляной (плотность 1,1 г/мл) на 4,0 г сульфида железа (II).
Решение. Сульфид железа (II) растворяется в соляной кислоте по уравнению
| 0,0455 | 0,091 | 0,0455 | 0,0455 | |||
| FeS | + | 2HCl | = | FeCl2 | + | H2S↑ |
m(р-ра НСl) = 25∙1,1 = 27,5 г. m(НСl) = 27,5∙0,2 = 5,5 г. v(НСl) = 5,5 / 36,5 = 0,151. v(FеS) = 4,0 / 88 = 0,0455. FeS находится в недостатке, и расчет по уравнению реакции надо вести по FеS.
В результате реакции образуется по 0,0455 моль FeСl2 (массой 0,0455∙127 = 5,78 г) и Н2S (массой 0,0455∙34=1,55 г), и расходуется 0,091 моль НСl. В растворе останется 0,151-0,091 = 0,06 моль НСl массой 0,06∙36,5 = 2,19 г.
Масса образовавшегося раствора равна:
m(р-ра) = 27,5 + m(FеS) - m(Н2S) = 27,5 + 4,0 - 1,55 = 30,0 г.
Массовые доли веществ в растворе:
ω(FеСl2) = 5,78 / 30,0 = 0,193, или 19,3%,
ω(НСl) = 2,19/ 30,0 = 0,073, или 7,3%.
Ответ. 19,3% FеСl2, 7,3% НСl.
Дата добавления: 2015-09-11; просмотров: 6154;
