Практическое занятие 3: Химическая связь и строение вещества
Цель занятия: Формирование навыков составления электронных формул невозбужденных и невозбужденных атомов и одноатомных ионов; умения характеризовать электроны атомов значениями квантовых чисел и определять свойства элементов и их соединений в зависимости от положения в периодической системе; формирование и закрепление представлений о пространственном строении веществ.
Требования к знаниям, которые студент должен приобрести в результате освоения темы:
знать: основные положения теории строения атома (ядра и состояния электронов); формулировку периодического закона; положения теории химической связи, виды и механизмы ее образования
уметь: описывать строение атомов элементов и объяснять периодичность изменения их свойств на основе строения их атомов;определять виды связей и объяснять пространственное строение веществ; применять знания закономерностей на конкретных примерах.
Теоретическая часть:
Согласно квантово-механическим представлениям состояние каждого элемента в атоме определяется значениями четырех квантовых чисел n, l, ml, ms.
Главное квантовое число n характеризует уровень энергии электрона в атоме и принимает целочисленные значения: 1, 2, 3, …, (n).
Орбитальное квантовое число l характеризует энергию электрона на подуровне и определяет форму электронного облака (рис.1). Принимает значения: 0, 1, 2, 3,…, (n – 1).
Магнитное квантовое число ml характеризует ориентацию электронного облака в пространстве и принимает значение в зависимости от значения l: –l,…, 0,…, +l, всего (2l+1) значений при данном значении орбитального квантового числа l.
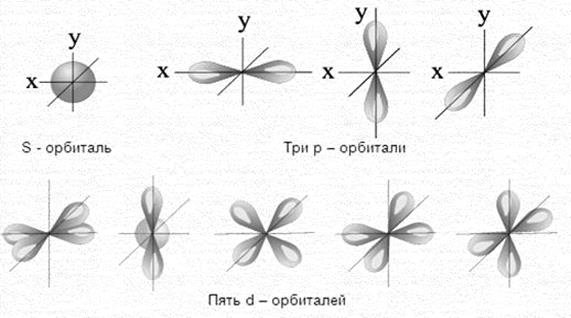
Рис. 1. Формы атомных орбиталей
Спиновое квантовое число ms характеризует собственный момент вращения электрона и принимает значения: + 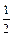 и –
и – 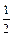 .
.
Максимальное число электронов на энергетическом уровне 2n2 (n – главное квантовое число), на подуровне – 2·(2l+1), где l – орбитальное квантовое число.
Положение электрона в атоме подчиняется ряду принципов. Согласно принципу Паули, в атоме не может быть двух электронов, имеющих одинаковое значение всех четырех квантовых чисел.
Одиночные электроны данного подуровня имеют одинаковые знаки спиновых квантовых чисел, т.е. такие электроны занимают наибольшее количество свободных атомных орбиталей (правилоХунда).
Заполнение электронами атомных орбиталей происходит в соответствии с постепенным увеличением значения суммы главного и орбитального квантовых чисел n и l (правила Клечковского):
| 1s22s22p63s23p64s2 | ||||||||
| 3d104p65s2 | ||||||||
| 4d105p66s2 | ||||||||
| 4f145d10 6p67s2 | ||||||||
| 5f146d10 | ||||||||
Атомы элементов характеризуются атомным радиусом (R, нм), энергией ионизации (I, эВ), сродством к электрону (Е, кДж/моль), относительной электроотрицательностью (ОЭО). Эти свойства периодически изменяются, что обусловлено закономерным повторением электронной конфигурации атомов с последовательным увеличением заряда ядра.
Одной из важнейших задач химии является изучение свойств элементов и выявление общих химических закономерностей их химического взаимодействия между собой. Самое крупное научное обобщение в этой области – периодический закон Д.И. Менделеева, который в современной формулировке представлен следующим образом: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины положительного заряда ядер их атомов.
Периодический закон является основой систематики химических элементов. Исследования показывают, что периодичность изменения свойств элементов зависит от периодически повторяющейся сходной структуры электронной оболочки их атомов. Химические и некоторые физические свойства зависят от структуры электронной оболочки, особенно от ее наружных слоев. Это объясняется тем, что периодичность присуща не только внешним слоям, но и всей электронной оболочке атомов.
Под орбитальным радиусом понимают теоретически рассчитанное положение главного максимума плотности электронных облаков. С ростом заряда ядра орбитальные радиусы в целом уменьшаются, поэтому изменение атомных и ионных радиусов носит периодический характер. В периодах, по мере увеличения заряда ядра атомные и ионные радиусы уменьшаются. Наибольшее уменьшение наблюдается у элементов малых периодов. Это объясняется тем, что у данных элементов происходит заполнение внешнего электронного слоя. В больших периодах в пределах семейств d- и f-элементов наблюдается более плавное уменьшение радиусов. В подгруппах элементов радиусы атомов и однотипных ионов увеличиваются.
Количественной характеристикой восстановительной способности атомов является энергия ионизации – энергия, необходимая для отрыва электрона от нейтрального атома. Если эта величина отнесена к заряду электрона, она называется потенциалом ионизации (напряжение электрического поля, достаточное для отрыва электрона, В). Энергия сродства к электрону является количественной характеристикой окислительной способности атомов. Это энергия, которая выделяется при присоединении электрона к атому. Величина энергии сродства значительно меньше, чем энергии ионизации тех же атомов.
И энергия ионизации, и энергия сродства к электрону изменяются в зависимости от изменения величины заряда ядра атома: с увеличением заряда в каждом периоде происходит увеличение энергии ионизации от щелочных металлов к инертным газам. В группах изменение энергии сложнее: в главных подгруппах увеличение радиуса сверху вниз более существенно, чем увеличение заряда ядер, поэтому энергия ионизации сверху вниз уменьшается. В побочных подгруппах такого преобладания не наблюдается, поэтому энергия ионизации изменяется не столь явно. Исследования показывают, что восстановительная способность атомов изменяется в широких пределах и в той или иной степени присуща всем атомам, тогда как окислительной способностью обладают только некоторые элементы (окислительная способность отсутствует у элементов I, II, III и VIII групп главных подгрупп и у всех побочных).
Электроотрицательность позволяет оценить способность атомов данного элемента оттягивать на себя электронную плотность по сравнению с другими элементами в данном соединении. Общая тенденция роста электроотрицательности наблюдается в периодах слева направо. В подгруппах сверху вниз значение электроотрицательности уменьшается.
Под химической связью понимают различные виды взаимодействий, с помощью которых реализуется устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллических веществ, и т.п.
Основными чертами химической связи являются:
Ø Снижение общей энергии двух- или многоатомной системы по сравнению с суммарной энергией изолированных частиц, образующих данную систему.
Ø Перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние связи.
Природа химической связи обусловлена взаимодействием положительно заряженного ядра с отрицательно заряженными электронами, а также электронов друг с другом.
Химическая связь может быть ионной, ковалентной (полярной и неполярной), металлической. Помимо этого, между молекулами в химическом соединении могут возникать более слабые взаимодействия: водородная связь и вандерваальсовы силы (межмолекулярные взаимодействия). Самой распространенной в природе является ковалентная связь. Большинство органических и неорганических соединений образуются благодаря образованию между атомами ковалентной связи. Ковалентная связь возникает между атомами неметаллов.
В результате образования ковалентной химической связи атомы могут приобретать электронную конфигурацию, соответствующую благородным газам, которые (за исключением гелия) имеют на внешней оболочке восемь электронов – октет. Стремление к созданию такой устойчивой электронной конфигурации называется правилом октета. Это правило справедливо и для ионной, и для ковалентной связи. Поскольку при образовании связи происходит понижение общей энергии системы, можно сделать вывод о том, что часть энергии выделяется. Такая энергия, выделившаяся при образовании одной связи, называется энергией связи (Есв, кДж). Для многоатомных соединений с одинаковыми связями энергия одной связи равна отношению энергии образования молекулы к количеству связей в этой молекуле. Чем выше энергия связи, тем устойчивее образованная молекула. Другой важной характеристикой является длина связи (lсв) – расстояние между ядрами атомов, образующих молекулу. По длине химической связи можно косвенно судить о такой важной ее характеристике как прочность. Чем ближе располагаются взаимодействующие атомы, тем полнее перекрываются их атомные орбитали. Следовательно, химическая связь тем прочнее, чем меньше ее длина. Энергия связи также зависит от степени перекрывания электронных оболочек и их размеров. Чем меньше длина связи, тем устойчивее молекула (больше Есв).
Химическая связь осуществляется в основном так называемыми валентными электронами. Для s- и p-элементов это электроны внешнего уровня, для d-элементров – s-электроны внешнего уровня и d-электроны предвнешнего уровня.
Химическая связь образуется только в том случае, если при сближении двух атомов полная энергия системы понижается.
Для описания химической связи широко используются 2 подхода: теория валентных связей (ТВС) и теория молекулярных орбиталей. Основателями ТВС являются В. Гейтлер и Ф. Лондон (1927 г.). Распространение метода Гейтлера –Лондона на многоатомные молекулы привело к созданию метода валентных связей (МВС), который разработали в 1928–1931 гг. Л. Полинг и Д. Слейтер.
Метод валентных связей основан на двух идеях:
1. химическая ковалентная связь возникает в результате спаривания электронов с противоположными спинами, принадлежащих разным атомам. Образующаяся связь является двухцентровой;
2. при образовании молекулы электронная структура составляющих ее атомов, в основном, сохраняется, а все химические связи в молекуле могут быть представлены набором фиксированных (локализованных) двухцентровых двухэлектронных связей. Такая связь в схемах изображается короткой линией. В целом же электронная структура молекулы выглядит как набор различных валентных схем (второе название метода – метод локализованных пар).
Если ковалентная связь образована одной общей электронной парой, то такая связь называется одинарной. Если между атомами возникает две или три общих электронных пары, то такие ковалентные связи называются двойными или тройными. Общее их название – кратные связи.
Электроны внешней оболочки, участвующие в образовании химической связи, могут изображаться точками (формула Льюиса), а связи – черточками.
Молекула HJ C2H4 N2



 Связь H – J H – C = C – H N = N
Связь H – J H – C = C – H N = N
 H H
H H
Формула
Льюиса H : J H : C : : C : H : N ∶ ∶N :
. . . .
H H
Название Простая Двойная Тройная
Для простых веществ можно изображать химическую связь с помощью квантовых ячеек:
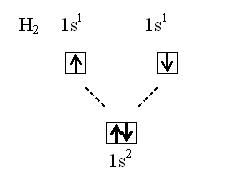
Схема показывает, что молекулярный энергетический уровень ниже исходных атомных уровней, следовательно, молекулярное состояние более устойчиво.
Существует два механизма образования ковалентной связи: обменный и донорно-акцепторный. При реализации обменного механизма общая электронная пара образуется за счет неспаренных электронов атомов, находящихся в невозбужденном состоянии. Пример образования такой пары электронов для молекулы водорода приведен выше. В возбужденном состоянии атомы также могут образовывать ковалентные связи. Например, атом углерода в основном состоянии имеет следующее электронное строение: 1s22s22p2. При переходе в возбужденное состояние (C*) 2s2-электроны распариваются, и один 2s-электрон переходит на 3р-подуровень (2s12p3). Такой переход можно представить схемой:
| С | ↑↓ | ↑ | ↑ | 
| С* | ↑ | ↑ | ↑ | ↑ |
Следовательно, становится возможным образование 4-х ковалентных химических связей, причем выделенная при образовании ковалентной химической связи энергия больше энергии, затраченной на возбуждение атома. Это и делает возможным такой переход электронов с одной оболочки на другую.
Если для перевода атома в возбужденное состояние необходимо больше энергии, чем высвободится при образовании связи, то переход атома в возбужденное состояние не реализуется, т.к. энергетически не выгоден.
Ковалентная химическая связь может возникать не только за счет обобществления электронов двух различных атомов, но и по донорно-акцепторному механизму. В этом случае атом/ион, обладающий избытком электронной плотности в виде неподеленной электронной пары, выступает в качестве донора, а атом/ион, имеющий свободную орбиталь – в роли акцептора.
Рассмотрим образование ковалентной связи по донорно-акцепторному механизму на примере молекулярного иона аммония NH4+. Ион аммония образуется при взаимодействии молекулы аммиака и иона водорода H+. Молекула аммиака NH3 образована по обменному механизму и имеет неподеленную электронную пару у атома азота. Ион водорода выступает в роли акцептора, предоставляя для образования связи свободную орбиталь.
NH3 + H+ → NH4+
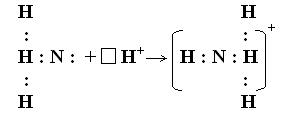
Ковалентной химической связи присущи такие свойства как насыщаемость и направленность. Атомные орбитали пространственно ориентированы, следовательно, перекрывание электронных облаков происходит по определенным направлениям. Это и обуславливает направленность ковалентной связи. Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах и твердых телах. В зависимости от способа перекрывания и симметрии образующегося облака различают сигма- (s–), пи- (p–) и дельта- (d–) связи. Сигма-связь (рис. 2) образуется при перекрывании электронных облаков вдоль линии соединения атомов, причем максимальное перекрывание облаков происходит вдоль линии, соединяющей центры атомов. При перекрывании электронных облаков по обе стороны от линии соединения атомов образуется пи-связь. Дельта-связь возникает при перекрывании d-электронных облаков всеми четырьмя лепестками одновременно.
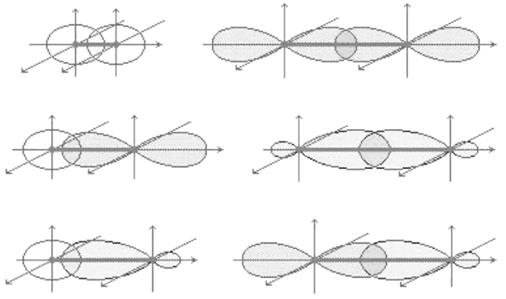
Рис. 2. Образование s– связи
Пространственную конфигурацию молекул определяет пространственное расположение сигма-связей. Различия в пространственной конфигурации молекул объясняются рядом теорий, одной из которых является теория гибридизации.
Как физический процесс гибридизация не существует, но представляет удобную модель наглядного описания молекул. Гибридная орбиталь возникает за счет комбинации нескольких атомных орбиталей s и р. Она больше вытянута по одну сторону ядра, чем по другую, т.е. электронная плотность сконцентрирована в ней по одну сторону в большей степени. Поэтому химическая связь, образованная с участием электрона гибридной орбитали должна быть более прочной. Характер гибридизации валентных орбиталей центрального атома и их пространственное расположение определяют пространственную конфигурацию молекулы (рис. 3). Насыщаемость ковалентной связи вызывается ограничением числа электронов, находящихся на внешних оболочках, которые могут участвовать в образовании ковалентной связи.
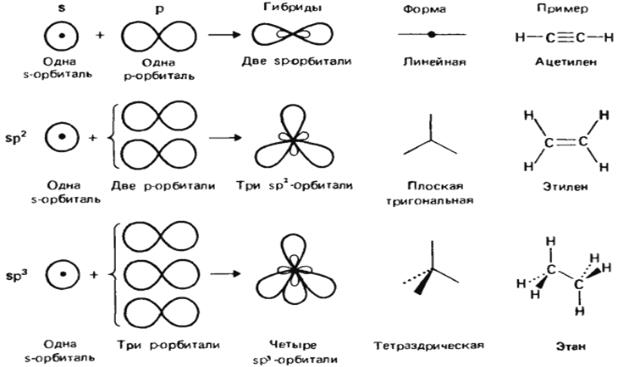
Рис.3. Процесс гибридизации
 В двухатомных молекулах простых веществ (H2, F2, Cl2, O2, N2 и т.д.) электронные пары, образующие ковалентные связи, в равной степени принадлежат обоим атомам, то есть общая электронная пара (пары) равномерно распределяется между ними. Следовательно, можно сказать, что общая электронная пара равноудалена от атомных ядер. Такая связь называется ковалентнойнеполярнойсвязью.
В двухатомных молекулах простых веществ (H2, F2, Cl2, O2, N2 и т.д.) электронные пары, образующие ковалентные связи, в равной степени принадлежат обоим атомам, то есть общая электронная пара (пары) равномерно распределяется между ними. Следовательно, можно сказать, что общая электронная пара равноудалена от атомных ядер. Такая связь называется ковалентнойнеполярнойсвязью.
Если ковалентная связь образована различными атомами (HF, H2O, HCl, H2S), то один из атомов притягивает общую электронную пару сильнее, смещая ее в свою сторону. Симметрия распределения зарядов нарушается, и связь становится полярной. Критерием способности атома притягивать электрон может служить электроотрицательность. Чем выше ЭО у одного из образующих связь атомов, тем более вероятно смещение электронной пары в сторону ядра данного атома. Разность ЭО атомов характеризует полярность связи. Мерой полярности связи является ее дипольный момент (μ), равный произведению эффективного заряда (q) на длину связи (lсв):
μ = q ∙ lсв
С увеличением разности электроотрицательностей атомов, образующих молекулу, дипольный момент возрастает. Если эффективный заряд стремится к 1, то связь можно считать ионной. Но даже в случае ионной связи q < 1, поэтому любая ионная связь имеет долю ковалентности. В большинстве случаев химическая связь сочетает свойства ковалентной и ионной связи, поэтому ее можно считать ковалентной химической связью с долей ионной связи, которая характеризуется эффективным зарядом, возрастающим с увеличением разности ЭО.
Помимо начального распределения электронной плотности для определения реакционной способности молекул необходимо учитывать и ее способность становиться полярной под действием внешнего электрического поля, т.е. поляризуемость. Под действием внешнего поля или при действии на молекулу других молекул может произойти полный разрыв связи. При этом общая электронная пара (пары) перейдет к одному из атомов, и образуются два иона: положительный и отрицательный. Такой разрыв связи называется гетеролитическим. Он отличается от разрушения связи, происходящего при распаде молекулы на атом и радикал (гомолитический разрыв).
В отличие от ковалентных, соединения с ионным типом химической связи менее распространены. Ионная связь возникает между элементами, сильно различающимися по электроотрицательности, например, между типичными металлами и типичными неметаллами. Вследствие значительной электроотрицательности атомов неметаллов, электронная плотность в пределе полностью смещается к более электроотрицательному атому, так что силы, действующие на частицы, можно считать чисто электростатическими:
Na – 1ē = Na+
Cl + 1ē = Cl–
Ионная связь – это химическая связь, образованная за счет электростатического притяжения между катионами и анионами. Поэтому для соединений данного типа характерны ионные кристаллы, в которых катионы и анионы располагаются упорядоченно в узлах кристаллической решетки.
В отличие от ковалентной связи, ионная связь не обладает направленностью и насыщенностью. Ненаправленность ионной связи объясняется тем, что электрическое поле, создаваемое ионом, распространяется равномерно по всем направлениям. Причина ненасыщенности ионной связи в том, что электрическое поле данного иона действует на все ионы противоположного знака. Вследствие ненасыщенности и ненаправленности ионные соединения образуют не молекулы, а ионные кристаллы. Количество ионов противоположного знака, которые окружают данный ион в кристаллической решетке, называется координационным числом.
Контрольные вопросы:
1. В чем заключается идея корпускулярно-волнового дуализма, дискретности энергии, принципа неопределенности?
2. Что характеризуют и какие значения принимают главное, орбитальное, магнитное и спиновое квантовые числа?
3. Укажите значения главного, орбитального и магнитного квантовых чисел для четвертого электрона, заполнившего 4p-, 4d-, 4f- подуровни.
4. Как распределяются в атоме электроны одного подуровня, заполненного наполовину? Чему равно их суммарное спиновое число?
5. Какова максимальная электронная емкость энергетических уровней и подуровней?
6. Как определяют последовательность заполнения электронами атомных орбиталей? Сформулируйте принципы Паули, Хунда, Клечковского.
7. Как отражает Периодическая система строение атомов химических элементов?
8. Как по электронной формуле, например, 1s22s22p63s23p63d54s2 определить период, группу, подгруппу элемента в периодической системе?
9. Как изменяются энергия ионизации, сродство к электрону и относительная электроотрицательность атомов элементов в периодах, группах и подгруппах периодической системы? Каковы причины этих изменений?
10. Как определяется и какими свойствами обладает химическая связь?
11. Какие свойства присущи ковалентной связи?
12. Каковы основные идеи метода валентных связей?
13. Как происходит образование химической связи по обменному механизму?
14. Как происходит образование химической связи по донорно-акцепторному механизму?
15. Как происходит процесс гибридизации? Ответ проиллюстрируйте соответствующими схемами.
Контрольные задания:
1. Напишите электронные формулы атомов рубидия (№37), йода (№53), циркония (№40), серебра (№47), хрома (№24), лантана (№57), самария (№62). Объясните последовательность заполнения энергетических уровней и подуровней в атомах, используя основные принципы и правила.
2. Определите значение квантовых чисел для электрона на 3d-подуровне:
| ↑↓ | ↑ | ↑ | ↑ | ↑ |
3. Напишите электронные формулы следующих ионов: Al+3; P-3; Mn+2; S+4; Cl+5; O-2.
4. Укажите число вакантных атомных орбиталей в атомах: Mn, Mg, Cl, S, Al.
5. Укажите число неспаренных электронов в атомах: N, F, Cu, Cr, O.
6. Составьте схемы, объясняющие образование химических связей в молекулах хлороводорода, сероводорода, воды, оксида алюминия, гидроксида кальция, кислорода. Определите тип химической связи.
7. Составьте схемы гибридизации, отражающие процессы образования следующих молекул: хлорид магния, гидрид бора, хлорид углерода, аммиак.
Рекомендуемая литература:
1. Глинка, Н.Л. Общая химия: учеб. пособие / Н. Л. Глинка; под ред. А. И. Ермакова. – М.: Интеграл-Пресс, 2009. – 728 с.
2. Тестовые задания по общей и неорганической химии с решениями и ответами: учеб. пособие / Р. А. Лидин [и др.]. – М.: БИНОМ; М.: Лаборатория знаний, 2004. – 231 с.
3. Родина, Т.А. Практикум по общей и неорганической химии: учеб. пособие/ Т.А. Родина, А.В. Иванов, В.И. Митрофанова; АмГУ, ИФФ. – Благовещенск: Изд-во Амур. гос. ун-та, 2008. – 208 с.
4. Охотникова Г.Г. Концепции современного естествознания: учеб. пособие/ Г.Г. Охотникова, Т.А. Родина, С.А. Лескова; АмГУ, ИФФ. Ч 4: Концептуальные системы химии. – Благовещенск: Изд-во Амур. гос. ун-та, – 2010. – 108 с.
Дата добавления: 2015-09-11; просмотров: 5596;
