О СТРУКТУРЕ ВОДЫ И РАСТВОРОВ
§ 6. Структура воды. Для того чтобы лучше разобраться в свойствах жидкой воды, необходимо хорошо понимать структуру изолированной молекулы воды в газообразном состоянии. Считали, что в основе строения молекулы воды лежит sp3-гибридизация валентных атомных орбиталей кислорода. В плоскости II под углом 120° расположены две гибридные электронные пары атома кислорода. В плоскости I углом 104,5° находятся два атома водорода. Молекула воды характеризуется тремя частотами колебаний (3652 см-1, 3756 см-1 – валентные и 1595 см-1-деформационное). Рентгенографический анализ показал, что для молекулы воды в т.ч. для твердого состояния (лед) характерна тетраэдрическая структура.
 Значительно сложнее дело обстоит со структурой жидкой воды. В настоящее время в основе лежит представление о том, что в жидкой воде существует три основных структурных образования (кластер,
Значительно сложнее дело обстоит со структурой жидкой воды. В настоящее время в основе лежит представление о том, что в жидкой воде существует три основных структурных образования (кластер,
ассоциат), находящихся в равновесии:
[Н2О]900–1000=[Н2О]4–5=[Н2О]1–2,
которое смещается с повышением температуры в сторону образования пара и с понижением температуры в сторону образования льда. В стандартных условиях доля первых порядка 70%, доля вторых 25%, доля последних менее 5%.
Согласно теории Самойлова при плавлении льда его структура полностью не разрушается. Таким образом, в жидкой воде сохраняются фрагменты ажурной структуры льда с «пустотами», заполненными кластерами воды Этим легко объясняется увеличение плотности при переходе от твердой фазы к жидкой. Правда, по мере повышения температуры льдоподобная структура постепенно разрушается, уменьшается число пустот, увеличивается количество более «свободных» молекул воды, для которых этих пустот уже не хватает.
Трудно подобрать более универсальный растворитель, чем вода. особенно для электролитов, так как она может прекрасно связываться как с катионами, так и с анионами. Огромная приспособляемость воды к веществу-партнеру, вероятно, и была главной причиной того, что первые живые организмы на Земле могли зародиться только в воде.
Многосторонность и разнообразие поведения воды лишний раз указывают, насколько С. Аррениус обеднил ее роль в процессах электролитической диссоциации, обратив внимание лишь на единственное ее свойство высокую диэлектрическую проницаемость.
§ 7. Структура водных растворов электролитов.Описание структуры растворов электролитов осложняется тем, что по мере увеличения концентрации растворенного вещества в растворе происходят последовательные структурные изменения раствора в целом. Поэтому целесообразно весь концентрационный интервал разделить на три области: область очень разбавленных растворов, растворы средних концентраций и область концентрированных растворов. Такое разделение в значительной степени условно, поскольку четких границ между указанными областями нет. В первом приближении можно считать, что первая область простирается до концентраций 0,1 моль, вторая – охватывает область от 0,1 до 3 моль, третья – выше 3 моль.
Долгое время считали, что растворы первой группы самые простые для понимания, что они близки к «идеальным» растворам, так как многие закономерности идеальных растворов (особенно изменение их термодинамических характеристик) сохраняются в сильно разбавленных растворах. Структура таких растворов определяется собственной структурой воды. Однако внедрение тонких и точных методов в исследования показало, что простота поведения очень разбавленных растворов только кажущаяся. При использовании обычных методов в этой зоне точность измерений, как правило. мала. поэтому большинство экстраполяции на бесконечное разбавление были условными. Не вызывает сомнения о обстоятельство, что именно структура чистой воды играет решающую роль при оценке поведения сильно разбавленных растворов. С учетом природы водородной связи (эстафетность, динамичность) структуры воды и водных растворов следует рассмотреть ее не только в пространственной, но и во временной шкале.
Наличие ближнего порядка приводит к тому, что молекулы воды в жидком состоянии не могут двигаться свободно, а осциллируют около положений равновесия в узлах квазикристаллической решетки с периодом около 10-13 с и только иногда совершают скачки к новому положению равновесия в другом узле. Молекула воды находится в узле квазикристаллической решетки в среднем
3×10-12 с и успевает совершить несколько десятков осцилляций. Примерно столько же времени сохраняется и водородная связь. Эти и более медленные движения можно наблюдать методом ЯМР. Время протонного обмена равно
3,8×10-4 с, время спонтанной диссоциации молекулы воды 4×104 с.
Поэтому, рассматривая данные, полученные тем или иным методом, вводят три структуры, характерные для молекул воды. Во-первых, это мгновенная, или
I-структура (от англ. instantaneous – мгновенный), которая представляет собой как бы мгновенный слепок молекулы воды, «моментальную фотографию». Во-вторых, это колебательно-усредненная, или V-структура (англ. vibrational),
наблюдаемая при помощи ЯМР и микроволновой спектроскопии, которые «не видят», усредняют более быстрые колебательные движения. В-третьих, это диффузионно-усредненная, или D-структура (англ. diffusional). Ее можно исследовать, например, методом ЯМР. Схематически шкала различных методов и движений показана на рис. 11.5, где через tel обозначен период вращения электрона на первой боровской орбите, tval – период валентных колебаний молекул, tvibr – период осцилляций молекул около положения равновесия, tres – время пребывания молекул в узле квазикристаллической решетки воды, tex – время протонного обмена, tdis – время спонтанной диссоциации воды (H2O → H+ + OH–).
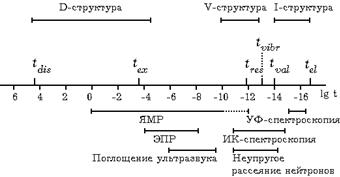
Рис. 11.5. Движение молекул воды и экспериментальные методы их наблюдения.
ЭПР–электронный парамагнитный резонанс.
 Таким образом, динамику движения молекул можно исследовать разными методами, которые дополняют и проверяют друг друга, поэтому в настоящее время динамические свойства воды установлены достаточно точно. Однако абсолютно чистой воды в природе не бывает — она всегда содержит примеси, растворенные газы и соли. Как наличие посторонних ионов отражается на структуре и динамике воды?
Таким образом, динамику движения молекул можно исследовать разными методами, которые дополняют и проверяют друг друга, поэтому в настоящее время динамические свойства воды установлены достаточно точно. Однако абсолютно чистой воды в природе не бывает — она всегда содержит примеси, растворенные газы и соли. Как наличие посторонних ионов отражается на структуре и динамике воды?
Для описания структуры растворов средних концентраций общепринятой в настоящее время является модель, предложенная Ивенсом и Вином. Сущность ее состоит в следующем. Раствор электролита можно представить как равновесную систему, образованную тремя основными зонами (рис. 11.6).
В каждой из этих зон, между которыми происходит непрерывный обмен, свойственный химическому равновесию, вода характеризуется своими
структурными особенностями. В ионной зоне структура воды определяется свойствами иона (катиона или аниона), зона деструктурированной воды является следствием существования зон WI и WW и обмена между ними. Вода в зоне WD не имеет ни собственной структуры воды, характеризующейся сетью водородных связей, ни структуры ионной зоны, имеющей ориентацию, диктуемую природой иона. Оно находится вне структурных связей, отсюда и ее название. Условие равновесия между зонами можно записать следующим образом:
WI ⇄ WD ⇄ WW.
Поскольку раствор – единая система, то любое изменение из структурных зон приведет к сдвигу равновесия между ними, в особенности это проявляется при внесении в раствор посторонних веществ или изменении концентрации самого электролита. Возникает вопрос: всегда ли присутствуют все три структурные зоны около ионов?
Остановимся на некоторых особых случаях и в первую очередь рассмотрим явление, названное О.Я. Самойловым «отрицательной гидратацией». Это явление наблюдается в растворах, в которых присутствуют ионы с малой плотностью заряда (Z/V), т.е. ионы больших размеров и малого заряда, например: К+, Rb+, Cs+, Tl+ ,Br–, I– .ClO4–. Около ионов такого типа ионная зона, будучи весьма неустойчивой, фактически не образуется, зона деструктурированной воды расширяется. Это сопровождается увеличением подвижности воды в зоне иона по сравнению с ее подвижностью в чистой воде. Такие растворы характеризуются так называемой «отрицательной вязкостью», когда текучесть водного раствора оказывается больше текучести чистой воды. В обычных ситуациях («положительная» вязкость) раствор всегда имеет большую плотность, вязкость по сравнения с чистой водой.
Особым случаем следует считать и тот, когда гидратация ионов или молекул происходит путем внедрения их в пустоты структуры воды, в результате чего образуются ассоциаты типа клатратов. Чаще всего такое явление имеет место при растворении газов в воде, однако некоторые ионы также обладают такой особенностью, как, например, ион тетраалкиламмония NR4+. Ионы, атомы или молекулы, внедряясь в пустоты растворителя, затормаживают их «дыхание». Это напоминает локальное замораживание, приводящее к образованию «айсбергов», «шуги» в речной воде в период ледостава и ледохода. Как и при замораживании, выделяется некоторое количество тепла, связанное с образованием новых соединений – клатратов, при этом структура растворителя стабилизируется, становится более жесткой. Такой способ взаимодействия называется «гидрофобной гидратацией», что означает гидратацию «без желания» к взаимодействию.
Рассмотрим способ ориентации молекул воды в зоне WI около положительно гидратированных катиона и аниона. К катиону вода, как правило, ориентируется двумя неподеленными электронными парами, а два атома водорода «торчат» наружу. Эта вода в определенной степени поляризована и стремится ориентировать молекулы воды соседнего слоя аналогичным образом. Тогда у катионов с
большой плотностью заряда может появиться вторая ионная зона (сфера), и только после этого образуется зона WD. Так или иначе в присутствии положительно гидратированного катиона всегда, появляется зона деструктурированной воды. Иначе обстоит дело с анионами. К аниону вода, как правило, ориентирована одним своим водородным атомом, а три ее конца (второй атом водорода и две неподеленные электронные пары) направлены в «толщу» раствора.
Такая ориентация молекул воды является предпосылкой для образования водородной связи во второй зоне. Таким образом, в окружении положительно гидратирозанного аниона отсутствует зона WD. Итак, по структурным соображениям в воде имеют место три вида гидратации: положительная, отрицательная, гидрофобная.
 Модель структуры растворов средних концентраций, предложенная Фрэнком, Ивенсом и Вином, выдержала испытание временем. В основе этой модели лежат собственная структура воды и ее изменение под влияние растворенного электролита.
Модель структуры растворов средних концентраций, предложенная Фрэнком, Ивенсом и Вином, выдержала испытание временем. В основе этой модели лежат собственная структура воды и ее изменение под влияние растворенного электролита.
Концентрированные растворы целесообразно разделить на два класса. К одному классу относятся растворы из которых образуются кристаллогидраты при осаждении, а к другому – растворы из которых при насыщении кристаллизуется безводный электролит (рис. 11.7).
С учетом изложенного структура водных растворов представляется многоплановой в пространственных и временных координатах и меняется от температуры, давления, природы и концентрации растворенных веществ, а также электромагнитных воздействий. Именно на основании этих теоретических представлений можно объяснять «живую» и «мертвую», «электролизную», «магнитную», талую, питьевую, техническую и т.д.
Лекция 18
Дата добавления: 2015-08-11; просмотров: 587;
