Химическая кинетика И катализ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ 6 страница
По способности образовывать внутриорбитальные комплексы (по величине) все лиганды можно расположить в ряд, который называется спектрохимическим рядом лигандов.
CN–>NO2–>SO32–>NH3>NCS–>H2O>OH–>F–>Cl–>Br–>I–
Он получил свое название, потому что окраска комплекса зависит от положения лиганда в этом ряду, и в этом проявляется связь оптических и магнитных свойств координационных соединений.
Известно, что большинство важных на практике химических реакций протекают в растворах, к ним относятся также и реакции комплексообразования, поэтому в следующем разделе мы рассмотрим магнитные свойства растворов, в которых соединения переходных металлов реализуются в виде комплексов.
§ 3. Комплексные соединения в растворах. Комплексные соединения катионного и анионного типа чаще всего растворимы в воде; в их водных растворах устанавливаются химические равновесия, иногда довольно сложные. Комплексы-неэлектролиты, как правило, малорастворимы в воде; растворившаяся часть комплексов ведет себя как слабый электролит.
Так, при растворении аммиачного комплекса серебра (I) [Ag(NH3)2]Cl или ферроцианида калия K4[Fe(CN)6] вначале происходит первичная электролитическая диссоциация – отщепляются ионы внешней сферы:
[Ag(NH3)2]Cl ® [Ag(NH3)2]+ + Сl–, K4[Fe(CN)6] ® 4K+ + [Fe(CN)6]4–
При первичной диссоциации комплекса, имеющего ионы внешней сферы, соединение ведет себя как сильный электролит – полностью отщепляет ионы внешней сферы. Затем происходит вторичная диссоциация комплекса уже по типу слабого электролита – отщепляются лиганды внутренней сферы.
Так, в случае аммиачного комплекса серебра наблюдается последовательное замещение молекул аммиака молекулами воды:
[Ag(NH3)2]+ + Н2О = [Ag(NH3)Н2О]+ + NH3
[Ag(NH3)Н2О]+ + Н2О = [Ag(Н2О)2]+ + NH3
Каждой ступени диссоциации внутренней сферы комплекса соответствует состояние ступенчатого химического равновесия, характеризующееся своей константой химического равновесия. Заметим, что при написании химических уравнений процессов диссоциации внутренней сферы комплекса в водных растворах молекулы воды чаще всего для краткости не записываются. Например, вместо уравнения
[Cu(NH3)4]2+ + Н2O = [Сu(NH3)3H2O)]2+ + NH3
упрощенно записывают
[Сu(NН3)4]2+ = [Сu(NН3)4]2+ + NH3
Рассмотрим процесс образования комплекса в растворе в общем виде (без указания зарядов М и лигандов): М + nL = MLn.
Поскольку это уравнение отражает химическое равновесие, то можно записать выражение для константы равновесия b:
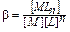 , (16.1)
, (16.1)
где все концентрации [MLn], [М] и [L] – равновесные. Величина b называется константой устойчивости комплекса. Обратная ей величина Кн, соответствующая равновесию диссоциации комплекса MLn = M + nL, выражаемая формулой:
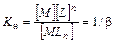 (16.2)
(16.2)
называется константой нестойкости или константой неустойчивости того же комплекса. Чем больше b, тем прочнее комплекс. Для устойчивых комплексов величина b имеет довольно высокие значения.
В качестве примера приведем константы устойчивости некоторых комплексов для водных растворов при температуре 20-30°С:
Cu2+ + 4NH3 = [Cu(NH3)4]2+ 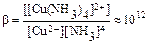
Al3+ + 4OН– = [Al(OH)4]– 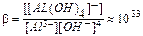
Знание констант устойчивости комплексов позволяет рассчитывать равновесные концентрации частиц в растворах, проводить сравнительную оценку прочности комплексов и т.д., что используется, например, в аналитической химии, при оптимизации технологических процессов, в медицине. Если, например, организм пересыщен соединениями какого-либо металла, что приводит к его отравлению различной степени сложности, то в организм вводят нетоксичные лиганды, которые образуют устойчивые растворимые комплексы с этим металлом, выводящиеся затем из организма. Если, напротив, в организме ощущается недостаток каких-либо металлов (например, дефицит железа при малокровии), то при лечении в организм вводят комплексные соединения этих металлов умеренной прочности.
Комплексные соединения участвуют в разнообразных химических реакциях, включая внутрисферное замещение одних лигандов на другие, диссоциацию лигандов, например молекул воды:
[PtCl3H2O]– + Н2О = [РtС13ОН|2– + Н3О+
Многие комплексные соединения являются катализаторами различных процессов гомогенного и гетерогенного катализа. Часто при получении лекарственных препаратов на основе фармакологически активных комплексных соединений удается понизить токсичность как металла, так и лигандов, связанных в комплексе, и модифицировать в желаемом направлении их биологическую активность.
§ 4. Номенклатура комплексных соединений. Комплексные соединения часто имеют довольно сложный состав и строение; к настоящему времени разработаны специальные системы составления их химического названия (номенклатуры). Существуют три основных подхода к номенклатуре комплексных соединений металлов.
1. Традиционные специфические вненоменклатурные названия, по которым различным комплексным соединениям присваивались те или иные наименования (например, K4[Fe(CN)6] – желтая кровяная соль, ферроцианид калия; К3(Fе(СN)6] – красная кровяная соль, феррицианид калия; [Pt(NH)4](OH)2 – первое основание Рейзе; транс–[Рt(ОН)2(NН3)2] – второе основание Рейзе; цис–[PtCl2(NH3)2] – хлорид Пейроне; К[Со(NO2)4(NН3)2] – соль Эрдмана и т.д.).
2. Номенклатура, предложенная основателем координационой теории швейцарским химиком Альфредом Вернером, принятая в несколько измененном виде его последователями.
3. Номенклатура, рекомендованная в 1960 г. комиссией по номенклатуре неорганических соединений Международного союза по чистой и прикладной химии (ИЮПАК).
В современной научной, учебной, медицинской литературе используются все три подхода, хотя можно отметить тенденции к преимущественному применению номенклатуры, рекомендованной ИЮПАК, как наиболее логически обоснованной. В русском языке эта номенклатура несколько модифицирована, адаптирована к правилам русского языка.
Согласно второй – комплексные катионывначале называют отрицательно заряженные лиганды внутренней сферы с окончанием «о» (хлоро-, бромо-, нитро-, родано-). Если их число больше одного, то перед названиями лигандов добавляют числительные ди-, три-, тетра-, пента-, гекса- и т.д. Затем называют нейтральные лиганды, причем молекулу воды называют «акво», молекулу аммиака – «аммин». Если число нейтральных лигандов больше одного, то добавляют числительные ди-, три-, тетра- и т.д.
После нейтральных лигандов называют атом металла-комплексо-образователя и в последнюю очередь – внешнесферные анионы. При этом наименование атома металла составляют из корня его латинского названия с характерным окончанием, зависящим от степени окисления центрального атома металла-комплексообразователя. Окончания эти следующие:
| Степень окисления | I | II | III | IV | V | VI | VII | VIII |
| Окончание | а | о | н | у | ан | он | ин | ен |
Например (для наглядности здесь и далее указана степень (состояние) окисления центрального металла, хотя обычно это не делается): [PtII(NН3)4]С12 – тетрамминплатохлорид; [PtIV(NН3)4С12]Cl2 – дихлоротетрамминплатехлорид; [CoIII(NН3)5С1]SO4 – хлоропентамминкобальтисульфат.
Для комплексных анионов вначале называют отрицательно заряженные лиганды с соответствующими числительными (ди-, три-, тетра-, и т.д.). Затем называют нейтральные молекулы, после чего идет название металла с соответствующим окончанием, характеризующим его степень окисления, к которому добавляют еще суффикс «ат». В заключение в родительном падеже называют внешнесферные катионы. Например: K[AgI(CN)2] – дицианоаргентаат калия; K2[PtCl6]] – гексахлороплатеат калия; K4[FeII(CN)6] – гексацианоферроат калия; Na3[FeIII(CN)6] – гексацианоферриат натрия.
Для нейтральных комплексовназвания строят аналогично предыдущему, за исключением того, что к наименованию металла-комплексообразователя не прибавляют никаких окончаний.
Например: [PtII(NH3)2Cl2] – дихлородиамминплатина; [CoIII(NН3)3(NО2)3] – тринитротриамминкобальт; [CrIII(NH3)3(SCN)3] – трироданотриамминхром.
Третью номенклатуру можно рассматривать как усовершенствованную и модернизированную номенклатуру А. Вернера. Лиганды называются так же, как и в вернеровской номенклатуре, т.е. отрицательно заряженные лиганды оканчиваются на «о», а нейтральные имеют обычные наименования.
Одноядерные комплексы.Вначале называют катион, затем – анион. При перечислении лигандов сначала называют отрицательно заряженные, затем – нейтральные с соответствующими числительными (ди-, три-, тетра- и т.д.). После этого называют атом металла-комплексообразователя, указывая после названия металла его степень окисления римскими цифрами в круглых скобках. Символ (0) используют для обозначения нулевой степени окисления. Если комплекс представляет собой анион, то к названию центрального атома добавляют суффикс «ат». Если лиганды представляют собой сложные многоатомные молекулы, то вместо числительных ди-, три-, тетра- и т.д. используют числительные бис-, трис-, тетракис-, пентакис-, гексакис-. Например
[Рt(NН3)4]Сl2 – тетрамминплатина (II) хлорид;
[Рt(NН3)4Cl2]Cl2 – дихлоротетрамминплатина (IV) хлорид;
[Co(NH3)5Cl]SO4 – гексамминкобальт (III) сульфат.
Если катион называют в родительном падеже (что в русском языке допускается), то наименования катиона и аниона пишут раздельно: [Co(NH3)6]Cl2 – гексамминкобальт (III) хлорид или гексамминкобальта (III) хлорид.
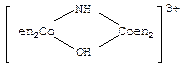
| бис(этилендиамин)кобальт(III)– m–имидогидроксобис(этилендиа мин)-кобальт(III)–ион. |
Полиядерные комплексы можно проклассифицировать на гетероядерные и гетеровалентные (смешанно-валентные); в гетероядерных два или более металлоцентра – разные металлы, в гетеровалентных – металлоцентры одного металла, но в разных степенях окисления. Для них характерно взаимодействие d-орбиталей, приводящее к изменению магнитных, оптических свойств, а также явлению переноса (миграции) электрона между металлоцентрами.
Координационная химия (химия комплексных соединений) длительное время считалась одним из разделов неорганической химии; объяснялось это тем, что большинство известных ранее координационных соединений содержало в качестве лигандов, как правило, типичные неорганические молекулы и ионы – аммиак, воду, нитро-, роданогруппу и т.п. Экспериментальные исследования неорганических комплексных соединений были начаты за несколько десятилетий до того, как стала бурно развиваться органическая химия. После создания А. Вернером координационной теории химия комплексных соединений стала постепенно, в течение десятилетий, превращаться в самостоятельный раздел химической науки. Ее успешное развитие связано с именами Трассера, Цейзе, Йергенсена, Грэма, Клауса, Бломстранда, школы А. Вернера, а в 20 в. – Л.А. Чугаева, И.И. Черняева, А.А. Гринберга, Чатта, Найхольма, Фишера, Бьеррума и многих других ученых различных стран. В наши дни координационная химия — интенсивно развивающаяся в различных направлениях наука, тесно переплетающаяся с другими областями химии. Достаточно отметить, что в нашем организме все ионы металлов находятся в форме комплексных соединений (гемоглобин!).
Лекция 17
Дата добавления: 2015-08-11; просмотров: 652;
