Химическая кинетика И катализ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ 5 страница
Fe0 + 2H2O ® Fe(OH)2 ¯+ H2 осадок грязно-зеленого цвета
4Fe(OH)2 + 2H2O + O2 ® 4Fe(OH)3 ¯ осадок бурый (ржавчина).
Причем
А.: 2Fe0 – 4  ® 2Fe2+ К.: 2H2O + O2 + 4
® 2Fe2+ К.: 2H2O + O2 + 4  ® 4OH–,
® 4OH–,
Тогда: Fe2++2OH–®Fe(OH)2.
Электрохимическая коррозия особенно опасна при контакте металлов с резко отличающимися значениями электродных потенциалов. Скорость коррозии пропорциональна ЭДС = jOX – jMe. Чем больше ЭДС, тем больше напряжение и ток, тем больше масса металла будет корродировать согласно закону Фарадея.
Например, коррозия латуни (сплав Zn и Cu) в растворе HCl.
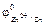 = –0,76 В,
= –0,76 В, 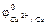 = +0,34 В
= +0,34 В
ЭДС = +0,34–(–0,76) = 1,1 В.
Образуется короткозамкнутый гальванический элемент Zn½HCl½Cu
А: Zn – 2  ® Zn2+; K: 2H+ + 2
® Zn2+; K: 2H+ + 2  ® H2.
® H2.
Zn0 + 2H+ = Zn2+ + H20 – токообразующая реакция.
§ 3. Защита от коррозии. Причины, вызывающие коррозионные разрушения, многочисленны. Соответственно, разнообразны и методы защиты. Основная схема электрохимической коррозии диктует и методы защиты:
1) обработка внешней (коррозионной) среды;
2) защитные покрытия;
3) электрохимическая защита;
4) изготовление специальных коррозионно-устойчивых сплавов (легирование);
5) рациональное конструирование.
Методы защиты нужно рассматривать, исходя из основной схемы электрохимической коррозии (приведена в «Практикуме» стр.71).
1. Сущность метода «обработка внешней среды» заключается в удалении или понижении активности веществ, способствующих коррозии: а) нейтрализации кислых сред, вызывающих коррозию за счет водородной деполяризации; б) деаэрации – удаление О2 осуществляется кипячением воды, в) продуванием воды инертным газом, г) введением в воду восстановителей, д) добавлением ингибиторов коррозии в раствор.
В качестве ингибиторов в воде и водных растворах применяются некоторые окислители–пассиваторы: нитраты, хроматы, бихроматы, персульфат натрия и пленкообразователи (фосфаты, амины). Замедлители атмосферной коррозии подразделяются на нелетучие (контактные) и летучие (парофазные). Ингибиторы избирательно адсорбируются на анодных или катодных участках и блокируют эти участки, тем самым замедляя или прекращая коррозию. По механизму воздействия ингибиторы разделяются на анионные, катионные и неионогенные.
2. Защитные покрытия. Роль защитных покрытий сводится к изоляции металла от воздействия внешней среды. На поверхность металла наносятся:
а) металлические покрытия, они подразделяются на анодные и катодные. К катодным покрытиям относятся покрытия, потенциал которых в данной среде имеет более положительное значение, чем потенциал основного металла, например, луженое железо (рис. 15.1б): 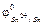 = –0,14 В,
= –0,14 В, 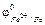 = –0,44 В.
= –0,44 В.
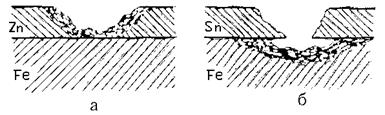
Рис. 15.1. Коррозия железа при нарушении металлических покрытий:
а – оцинкованное (анодное покрытие); б – луженое (катодное покрытие).
А: Fe – 2  ® Fe2+
® Fe2+
К: 2H2O + O2 + 4  ®4OH–
®4OH–
Идет разрушение металла-изделия.
У анодного покрытия j покрывающего металла более отрицателен, чем основного (защищаемого) Ме (рис. 15.1а).
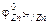 = –0,76 В;
= –0,76 В; 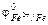 = –0,44 В.
= –0,44 В.
А.: Zn – 2  ® Zn0
® Zn0
К.: 2H2O + O2 + 4  ® 4OH–
® 4OH–
Пока защитный слой полностью изолирует основной металл от окружающей среды, принципиального различия между катодными и анодными покрытиями нет. При нарушении целостности анодное покрытие разрушается, а изделие – нет.
Кроме того, к металлическим покрытиям относятся также покрытия, полученные металлизацией – на защищаемое изделие с помощью сжатого воздуха распыляется расплавленный другой металл. Возможность нанесения покрытия на собранные конструкции и хорошее сцепление с основой дает этот метод.
Термодиффузионные покрытия – этот способ широко используется для получения жаростойких покрытий (алитирование, хромирование, титанирование). Изделие помещают в смесь, содержащую порошок покрытия. При высоких температурах происходит диффузия наносимого металла в основной металл-изделие.
Плакирование – покрытие сплава чистым металлом. Толщина плакирующего слоя не превышает 5-10% от толщины сплава.
Воронение – нанесение на сталь оксидных пленок горячим раствором (NaOH + NaNO3) и образование пленки Fe3O4 (FeO, Fe2O3) цвета «воронова крыла».
Фосфатирование – образование фосфатной пленки на стали. Изделие при 95-98°С погружают в 3% раствор «мажефа» (Mn(H2PO4)2 и Fe(H2PO4)2) выдерживают в этом растворе до прекращения выделения Н2 с последующей кристаллизацией фосфатов Fe и Mn в виде черного осадка.
Анодирование – Al и Ti и других вентельных металлов с образованием оксидной пленки.
Органические покрытия: лаки, краски, эмали на основе органических полимеров; гуммирование – нанесение на металл сырой резины с последующей вулканизацией и образованием покрытия на металле.
3. Метод электрохимической защиты основан на торможении анодных или катодных реакций коррозионного процесса.
Уменьшение или полное прекращение коррозии достигается созданием на защищаемом изделии высокого электроотрицательного потенциала.
а) протекторная защита – защищаемое изделие соединяют с металлом, имеющим высокий электроотрицательный потенциал.
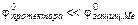 . Протектор является анодом и растворяется, защищаемое изделие – катод. Например, корпус морского корабля (сталь) – протектор может быть Al, Mg, Zn.
. Протектор является анодом и растворяется, защищаемое изделие – катод. Например, корпус морского корабля (сталь) – протектор может быть Al, Mg, Zn.
А.: Mg – 2  ®Mg2+
®Mg2+
К.: 2H2O + O2 + 4  ®4OH–
®4OH–
б) катодная защита – защищаемое изделие подключается к отрицательному полюсу внешнего источника тока, он становится катодом, а анодом служит вспомогательный металлический электрод. Анод растворяется, на защищаемом изделии (катоде) выделение Н2:
А.: Ме – n  ®Men+;
®Men+;
К.: 2H+ + 2  ®H2.
®H2.
Коррозию подземных сооружений вызывают так называемые «блуждающие токи». Они обусловлены утечкой постоянного тока с рельсов электрического транспорта в землю. Место входа «блуждающего тока» в подземное металлическое сооружение является катодом, а место выхода из него – анодом. Для защиты от коррозии находят анодный участок методом дренажа и соединяют его с источником «блуждающего тока» (трамвайным рельсом), тогда весь ток проходит по этому проводнику и коррозия не происходит.
4. Изготовление специальных коррозионноустойчивых сплавов (легирование). Легирование – это введение при выплавке основного металла коррозионноустойчивых компонентов, вызывающих пассивацию металла. Сталь легируют: Cr, Mo, Ni, Co и другими металлами. Легирующие компоненты добавляются согласно правила Таммана – порог коррозионной устойчивости кратен 1/8 атомной доли легирующего компонента.
5. Рациональное конструирование. При конструировании важно предвидеть контактирующие детали металлического сооружения, которые могут подвергнуться интенсивной коррозии. В многоэлектродном элементе разделение на катод и анод не столь однозначно, как у двухэлектродных систем и полярность электродов может изменяться в зависимости от условий. Важно отметить, что железо, как основной металл, подвергающийся коррозии, необходимо «сделать» катодом.
Итак, коррозию металла можно затормозить или даже прекратить. Выбор способа защиты определяется его эффективностью, а также экономической целесообразностью.
Лекция 16
КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ
В данной лекции мы рассмотрим третий тип основных химических реакций – реакций комплексообразования, реализуемых за счет неподеленных пар электронов (орбиталей) молекул, ионов и вакантных (пустых) орбиталей ионов металлов. Отметим, что это преимущественно – переходные металлы, имеющие вакантные d-орбитали. Ранее мы рассмотрели с вами реакции кислотно-основного равновесия (с участием и переносом протона) и окислительно-восстановительные (с участием и переносом электрона). Молекулы и ионы с неподеленными парами называют лигандами, которые координируются вокруг центрального иона, имеющего вакантные орбитали с определенной степенью насыщенности и направленностью химических связей.
Комплексные (координационные) соединения чрезвычайно широко распространены в живой и неживой природе, применяются в промышленности, сельском хозяйстве, науке, медицине. Так, хлорофилл – это комплексное соединение магния с порфиринами, гемоглобин содержит комплекс железа (II) с порфириновыми циклами (лигандами). Многочисленные минералы, как правило, представляют собой координационные соединения металлов. Значительное число лекарственных препаратов содержит комплексы металлов в качестве фармакологически активных веществ, например инсулин (комплекс цинка), витамин В12 (комплекс кобальта), платинол (комплекс платины) и т.д. В широком смысле слова почти все соединения металлов можно считать комплексными соединениями, а в растворах это – основная форма существования соединений металлов. Основателем координационной теории комплексных соединений является швейцарский химик Альфред Вернер (1866-1919); за работы в этой области ему в 1913 г. была присуждена Нобелевская премия по химии.
§ 1. Основная характеристика комплексных соединений. Комплексные соединения образуют как металлы, так и неметаллы. В дальнейшем мы будем рассматривать в основном комплексные (координационные) соединения металлов. Комплексное соединение (сокращенно – комплекс) состоит из центрального атома (иона) металла-комплексообразователя М (здесь не указан его заряд), с которым связаны лиганды – L (старое название – адденды). Атом М и лиганды L образуют внутреннюю сферу комплекса (или внутреннюю координационную сферу). Внутренняя координационная сфера обычно при написании формулы соединения заключается в квадратные скобки. Лигандами могут быть нейтральные молекулы (обычно основного характера), отрицательно заряженные анионы (ацидогруппы). Простые положительно заряженные катионы в роли лигандов не выступают. Если внутренняя сфера комплекса несет отрицательный или положительный заряд, то для компенсации этого заряда (поскольку все индивидуальные соединения электронейтральны) необходимы ионы, образующие внешнюю
сферу. Во внешней сфере могут находиться не только ионы, но и нейтральные молекулы, очень часто – молекулы воды. Приведем несколько примеров:
1. Рассмотрим комплекс состава K4[Fe(CN)6]×ЗН2О – тригидрат гексацианоферрата (II) калия (ферроцианид калия, желтая кровяная соль). Здесь в роли центрального атома металла-комплексообразователя выступает ион железа (II), в роли лигандов – шесть одинаковых цианогрупп (ионов) CN–. Вместе атом железа (II) и шесть цианогрупп образуют внутреннюю координационную сферу комплекса, что в написанной выше химической формуле соединения обозначено квадратными скобками. Во внешней сфере в данном случае находятся четыре катиона калия (они компенсируют отрицательный заряд внутренней сферы) и три молекулы воды.
2. Рассмотрим теперь комплексы платины (II) состава транс-[Рt(NН3)2Сl2], [Pt(NН3)4]Cl2 и K2[PtCl4]. В первом комплексе внешняя сфера отсутствует, поскольку внутренняя координационная сфера электронейтральна. У второго комплекса во внешней сфере имеются два хлорид-иона (Сl–), так как внутренняя сфера комплекса [Pt(NН3)4]2+ несет положительный заряд, равный +2. В третьем комплексе во внешней сфере находятся два катиона калия (К+), поскольку внутренняя сфера [PtCl4]2– несет отрицательный заряд. Иногда в роли внешней сферы одного комплекса выступает внутренняя сфера другого комплекса, например, как в соединениях состава:
[Pt(NH3)4][PtCl4], [Со(NH3)4][Сг(СN)6], [Co(NH3)5NO2][Co(NH3)2(N02)4]2.
Нейтральные молекулы (но не ионы!), находящиеся во внешней сфере, называют (за исключением молекул воды или другого растворителя) клатратными молекулами, а сами такие соединения – клатратными соединениями (соединениями-включения). Например в комплексе никеля (II) состава NiI2·10А, где А – молекула карбамида (мочевины) – OC(NH2)2, на один атом никеля приходятся десять молекул карбамида, однако только шесть из них входят во внутреннюю сферу комплекса; четыре остальные молекулы карбамида и два иодид-иона (I–) образуют внешнюю сферу. Эти четыре молекулы карбамида являются клатратными молекулами. Состав комплекса в целом можно представить следующим образом: [NiA6]I2×4A.
Заметим, что иногда клатратами называют химические соединения, образуемые растворенными газами (Cl2, О2)в водных растворах.
Лиганд L образует с металлом-комплексообразователем М координационную связь различной химической природы (ионная, ковалентная, полярная; по происхождению – донорно-акцепторная, дативная или иной природы). Координационная связь может быть ординарной (одинарной), двойной. Координационные соединения, в которых два и более центральных иона, соединенных мостиковыми лигандами (m), называют полиядерными (многоцентровыми).
§ 2.Координационное число(к.ч.,или n) центрального атома М – это число координационных связей, образуемых атомом (ионом) металла-комплексо-образователя с лигандами. К.ч. может иметь значения от 2 до 12 (например, для некоторых соединений редкоземельных металлов). Наиболее часто встречаются к.ч. 4, 6. Ясно, что с точки зрения гибридизации первые – это тетраэдр или квадрат, вторые – октаэдр. Например, для n=4:
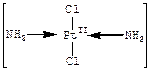
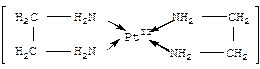
Число координационных связей, образуемых одним и тем же лигандом с одним атомом металла-комплексообразователя, называется дентатностью лиганда (старое название – координационная емкость). Лиганды могут быть монодентатными и полидентатными (би-, три-, тетра-, пента-, гексадентатными).
К монодентатным лигандам относятся F–, СI–, С, Br–, I–, H–, CN–, RNH2, NH3, H2O и т.д. Они образуют только одну координационную связь (если исключить из рассмотрения возможность образования мостиковых связей между двумя атомами металла М-CN-М).
| Бидентатные лиганды функционируют, например, в комплексах [Соеn2СО3] октаэдрического строения (en – сокращенное обозначение молекулы этилендиамина NH2-CH2-CH2-NH2): Здесь каждая из двух молекул этилендиамина реализует бидентатную координацию в металлоцикле: К тридентатным лигандам относится, например, триаминопропан NH2CH2-CHNH2-CH2NH2 в комплексе (к.ч. 6): | 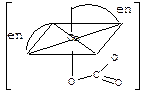
|
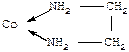
|
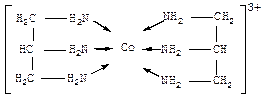
В роли гексадентатного лиганда может выступать, например, анион этилендиаминтетрауксусной кислоты:
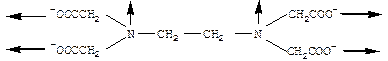
Полидентатные лиганды не обязательно должны реализовать свою макси-
мальную дентатность; они могут занимать и меньшее число координационных мест во внутренней сфере комплекса.
Иногда понятия координационного числа центрального атома М или дентатности лиганда формально становятся неопределенными, например, в ферроцене Fе(С5Н5)2 – ди-p-циклопентадиенилжелезе, в дибензолхроме Сr(С6Н6)2:
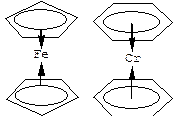
Ферроцен Дибензолхром
Здесь атом металла (железа или хрома) связан не с каким-то определенным донорным атомом лиганда, а целиком со всем лигандом – циклопентадиенилом (С5Н5), (однократно депротонированным остатком молекулы циклопентадиена) или молекулой бензола. Соединения подобного типа называют p-комплек-сами, или ароматическими комплексами металлов (если лиганд – ароматическое соединение; понятие «p-комплекс» – более широкое, чем понятие «ароматический комплекс»), еще их называют «сэндвичевыми».
Комплексные соединения могут быть катионного типа, анионного типа и комплексами-неэлектролитами.
Внутренняя сфера комплексов катионного типа несет положительный заряд: [Ag(NН3)2], [Cu(NH3)4]2+, |PtEn2]2+, [Co(NCS)2En2]+. Внутренняя сфера комплексов анионного типа несет отрицательный заряд: [Ag(S2O3)2]3–, [Sb(OH)6]–, [Co(NO2)6]3–, |HgI4]2–, [Pt(SCN)4]2–. Внутренняя сфера комплексов-неэлектроли-тов не несет никакого электрического заряда: [Pt(NH3)2Cl2], [Ni(ДМГ)2], где ДМГ-молекула диметилглиоксима (Н3С–С=NОН)2, [Рt(NН3)2СL4], [ZnL2], где L – молекула 8-оксихинолина.
Если комплекс содержит только один атом металла-комплексо-образователя, то он называется одноядерным (моноядерным); если он содержит два или более атомов центрального металла, то он называется многоядерным или полиядерным (биядерным, триядерным). Так, например, комплекс палладия (II) [PdCl4]2–, имеющий только один центральный атом – атом палладия (II), является одноядерным, а комплекс платины (II) [Pt2(NH3)2Cl2], содержащий два атома платины (II), – биядерным, [Pd6Cl14]2– – гексаядерным.
Если полиядерные комплексы содержат атомы металла одинаковой химической природы, то они называются гомометаллическими; если же в полиядерном комплексе имеются атомы металла-комплексообразователя разной химической природы, то такие комплексы называются гетерометаллическими. Так, из двух биядерных комплексов
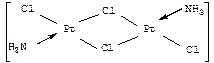
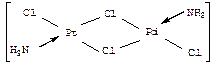
первый является гомометаллическим (оба центральных атома — атомы
платины (II), а второй — гетерометаллическим (содержит один атом платины и один атом палладия).
Если лиганд связан в полиядерном комплексе одновременно с двумя или даже с тремя атомами металла, то такой лиганд называется мостиковым лигандом, как, например, два m-хлоролиганда. В многоядерных комплексах могут осуществляться также связи металл-металл. Если связей металл–металл достаточно много (обычно – больше трех), то такие комплексы называют «кластерными соединениями» или просто «кластерами» (слово «кластер» в переводе на русский язык означает «рой», «скопление»).
Говоря о природе хим. связи, рассмотрим комплексный катион тетраамин меди ([Cu(NH3)4]2+), к.ч. 4 – 4 хим. связи. Каждая такая координационная связь Cu2+ – аммиак образуется за счет оттягивания «свободной» электронной пары от атома азота молекулы аммиака на пустую атомную орбиталь Cu2+, что в записи химической формулы обозначается стрелкой, направленной от донора к акцептору. Донором электронной пары, таким образом, является молекула аммиака, акцептором электронной пары – 4d-орбитали Cu2+. В результате обобществления электронных пар и образуются четыре координационные связи Cu2+ – аммиак, строение – квадратная конфигурация, в то же время для [Cu(NH3)6]2+ строение – октаэдр, обуславливающее интенсивно синий цвет.
В комплексном ферроцианид-ионе [Fe(CN)6]4– имеются шесть координационных связей железо (II) – цианогруппа.
Механизм образования таких связей в качественной форме можно представить следующим образом. Цианид-ион CN– имеет «свободную» электронную пару, которая оттягивается при комплексообразовании к атому Fe2+, в результате чего возникает s-донорно-акцепторная (от лиганда к металлу) составляющая координационной связи. С другой стороны, атом Fe2+ с d-электронной конфигурацией 3d6 может донировать свои d-электроны на пустую разрыхляющую молекулярную p-орбиталь цианогруппы, в результате чего возникает p-дативная (от металла к лиганду), составляющая координационной связи. В итоге обобществления электронов как лигандов (цианогрупп), так и металла-комплексообразователя (железа (II)) возникает двойная ковалентная полярная координационная связь железо (II) – цианогруппа. Вследствие всех этих перераспределений электронной плотности в шести координационных связях Fe2+ – цианогруппа положительный заряд на атоме Fe2+ уже не равен двум, а отрицательный заряд на цианогруппе также уже не равен минус единице. Другими словами, в действительности в ферроцианид-ионе [Fe(CN)6]4– нет ни катиона Fe2+, ни анионов CN–, а существует устойчивая группировка связанных между собой металла-комплексообразователя и лигандов.
Аналогичная картина характерна и для большинства других комплексов металлов, в которых многозарядные катионы металлов в действительности не существуют, поскольку комплекс состоит не из “чистых” ионов, а из центрального атома металла и лигандов, обобществивших свои электроны.
Отметим, что сказанное относится к частицам внутренней координационной сферы. Во внешней же сфере присутствуют катионы и анионы с зарядами, соответствующими их ионному состоянию. Например, в комплексе K4[Fe(CN)6] во внешней сфере имеются четыре катиона калия К+; во внешней сфере комплекса [Ag(NH3)2]Cl находится хлорид-анион Сl–.
Вышеприведенное краткое рассмотрение природы координационных связей в рамках метода валентных связей является упрощенным и лишь в качественной форме отражает реальную картину. В настоящее время наиболее распространенными являются три подхода к пониманию природы химической связи в координационных соединениях металлов: теория кристаллического поля, метод валентных связей и теория (метод) молекулярных орбиталей. Наиболее строгую картину можно получить с помощью метода молекулярных орбиталей. Геометрическая конфигурация строения внутренней сферы комплексов бывает различной: линейная, треугольная, квадратная, тетраэдрическая, октаэдрическая, пирамидальная, бипирамидальная и т.д., в зависимости от природы центрального атома металла, лигандов, внешнесферного окружения. Структура комплексов экспериментально обычно устанавливается рентгеноструктурным и спектральными методами. Важно отметить, что в комплексных соединениях d-орбитали, участвующие в образовании «дополнительных» химсвязей, расщепляются в соответствии с их геометрией и природой лигандов, так что образование комплекса приводит к дополнительному выигрышу энергии (устойчивость) по сравнению со свободными лигандами и ионом-комплексообразователем. Но это предмет рассмотрения теории поля лигандов в химии комплексных соединений.
Координационные соединения образуются, как правило, за счет донорно-акцепторной связи, то есть неподеленные пары электронов лигандов занимают вакантные места на орбиталях центрального атома. При этом количество неспаренных электронов и магнитный момент ионов-комплексообразователей остается таким же, как и у свободного иона в газовой фазе. Это справедливо, например, для аквакомплексов переходных металлов, например железа (II):
| 3d | 4s | 4p | 4d | |||||||||||
| Fe2+ | ¯ | | | | | |||||||||
| [Fe(H2O)6]2+ | ¯ | | | | | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | |||
| [Fe(CN)6]4– | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ |
Однако существуют также магнитно-аномальные комплексы, магнитный момент которых ниже, чем у газообразного иона. Их электронную структуру можно объяснить в рамках метода валентных связей следующим образом. Очень многие комплексные соединения имеют координационное число шесть. Шесть лигандов симметрично расположены в вершинах октаэдра. Для того чтобы получить шесть гибридных орбиталей, в их образовании должны принять участие шесть валентных орбиталей центрального атома: такое перераспределение электронной плотности называется sp3d2-гибридизация (сравните с sp3-гибридизацией атома углерода в алканах, где четыре связи направлены к вершинам тетраэдра). Обратите внимание, что в образовании гибридных орбиталей принимают участие d-орбитали с таким же порядковым номером, что и s-, p-орбитали. Это объясняется тем, что расположенные ниже по энергии внутренние d-орбитали заняты собственными электронами иона металла. Для того чтобы занять расположенные ниже по энергии орбитали, лиганды должны вынудить собственные электроны иона металла «спариться» и освободить внутренние d-орбитали для так называемой d2sp3-гибридизации. Это могут сделать только лиганды сильного поля, образующие прочные связи с ионом металла, например, цианид-ионы в комплексном гексацианоферрате (II) (см. выше).
Соответственно первый тип комплексов, обладающий высоким магнитным моментом, называются внешнеорбитальными комплексами, а второй тип с пониженным магнитным моментом – внутриорбитальными комплексами. Это различие, приводящее к изменению числа неспаренных электронов в комплексе, приводит к изменению магнитных моментов внешнеорбитальных и внутриорбитальных комплексов соответственно, вызвано энергетической неравноценностью соответствующих d-орбиталей (обычно ее называют энергией расщепления в поле лигандов и обозначают D или 10Dq).
Дата добавления: 2015-08-11; просмотров: 634;
