Химическая кинетика И катализ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ 4 страница
Переход ионов металла с электрода в раствор приводит к равновесному состоянию системы. Потенциал, устанавливающийся в условиях равновесия ( 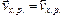 ), называется равновесным электродным потенциалом и зависит от свойств металла, концентрации его ионов в растворе. Абсолютные значения электродных потенциалов определить экспериментально невозможно. Поэтому пользуются относительными значениями электродных потенциалов. Для этого находят разность потенциалов измеряемого электрода и электрода, потенциал которого условно принимают равным нулю.
), называется равновесным электродным потенциалом и зависит от свойств металла, концентрации его ионов в растворе. Абсолютные значения электродных потенциалов определить экспериментально невозможно. Поэтому пользуются относительными значениями электродных потенциалов. Для этого находят разность потенциалов измеряемого электрода и электрода, потенциал которого условно принимают равным нулю.
В настоящее время за нуль отчета принят потенциал стандартного водородного электрода. Он состоит из платинированной платины, контактирующей с
газообразным водородом и раствором HCl с СН+=1 моль/л, р = 1атм, T = 298 К (25°С), рН = 0. Возникает скачок потенциала за счет реакции 2Н++2  ⇄ Н2 между платиной и раствором.
⇄ Н2 между платиной и раствором.
Более подробно процессы, происходящие на платиновом электроде, можно представить схемой:
H2 (г.) ⇄ H2 (адс. Pt) ⇄ 2H (адс. Pt) 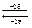 2H+ (адс. Pt) ⇄ 2H+ (р-р)
2H+ (адс. Pt) ⇄ 2H+ (р-р)
Обычно промежуточные стадии при кратком описании не приводят, но нужно помнить, что без развитой поверхности черненого платинового электрода равновесие между газовой фазой и раствором устанавливалось бы слишком долго.
Здесь уместно напомнить уравнение Нернста:
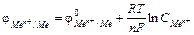 (14.1)
(14.1)
Стандартным электродным потенциалом металла 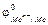 называют потенциал, который возникает на границе между металлом и раствором его соли с концентрацией ионов металла
называют потенциал, который возникает на границе между металлом и раствором его соли с концентрацией ионов металла 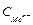 =1 моль/л при стандартных условиях, эта величина табулирована. Это количественная характеристика способности металла окисляться или восстанавливаться.
=1 моль/л при стандартных условиях, эта величина табулирована. Это количественная характеристика способности металла окисляться или восстанавливаться.
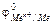 измеряется относительно стандартного водородного электрода. Таким образом измерены стандартные потенциалы
измеряется относительно стандартного водородного электрода. Таким образом измерены стандартные потенциалы 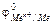 для всех металлов и они расположены в порядке возрастания величин этих потенциалов. Ряд стандартных электродных потенциалов называется рядом напряжений или рядом электрохимической активности металлов. Исходя из этого ряда можно сделать выводы: чем меньше
для всех металлов и они расположены в порядке возрастания величин этих потенциалов. Ряд стандартных электродных потенциалов называется рядом напряжений или рядом электрохимической активности металлов. Исходя из этого ряда можно сделать выводы: чем меньше 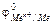 , тем выше активность металла к окислению, а его ионам труднее восстанавливаться. Чем больше
, тем выше активность металла к окислению, а его ионам труднее восстанавливаться. Чем больше 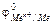 , тем металл труднее окисляется, а ионы легче восстанавливаются.
, тем металл труднее окисляется, а ионы легче восстанавливаются.
В электрохимии используются металлические и газовые электроды.
Металлический электрод. При погружении металла в раствор собственных ионов устанавливается равновесие Me ⇄ Men++n  . Для его измерения нужен гальванический элемент H2 Pt|H+||Men+|M. Токообразующей в этом элементе будет реакция Men++
. Для его измерения нужен гальванический элемент H2 Pt|H+||Men+|M. Токообразующей в этом элементе будет реакция Men++ 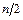 H2 ⇄ Me+nH+. Скачок потенциала на границе Ме/электролит определяется по уравнению (14.1). Если электрод инертный (графитовый, угольный, Pt), то он является только передатчиком электронов, но в реакции сам не участвует.
H2 ⇄ Me+nH+. Скачок потенциала на границе Ме/электролит определяется по уравнению (14.1). Если электрод инертный (графитовый, угольный, Pt), то он является только передатчиком электронов, но в реакции сам не участвует.
Газовые электроды состоят из металлического проводника, контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Металлический проводник служит для отвода и подвода  . Наиболее часто используются водородный и кислородный газовые электроды. Скачок потенциала водородного электрода возникает на границе Н2/Н+ и потенциалоопределяющей является реакция 2H++2
. Наиболее часто используются водородный и кислородный газовые электроды. Скачок потенциала водородного электрода возникает на границе Н2/Н+ и потенциалоопределяющей является реакция 2H++2  ⇄ H2, выражающая равновесие на водородном электроде.
⇄ H2, выражающая равновесие на водородном электроде.  в нестандартных условиях можно рассчитать по уравнению (10.1), используя парциальное давление вместо концентрации водорода и при
в нестандартных условиях можно рассчитать по уравнению (10.1), используя парциальное давление вместо концентрации водорода и при  =1 моль/л, рН=0.
=1 моль/л, рН=0. 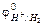 определяется по формуле
определяется по формуле 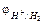 =–0,059рН.
=–0,059рН.
Аналогично водородному можно создать и кислородный электрод. Для этого необходимо Pt пластинку привести в контакт с O2 и раствором, содержащим ионы ОН–. Скачок потенциала происходит на границе О2/ОН– и протекают процессы 4Н+ + О2 + 4  ⇄ 2H2O, 2H2O + О2 + 4
⇄ 2H2O, 2H2O + О2 + 4  ⇄ 4ОН–, потенциал определяет по уравнению;
⇄ 4ОН–, потенциал определяет по уравнению; 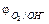 = 1,23 – 0,059 рН.
= 1,23 – 0,059 рН.
§ 2. Химические источники тока.Химические источники тока (ХИТ) представляют устройства, в которых химическая энергия Ox/Red реакции превращается в электрическую. ХИТы по принципу действия делятся на первичные – гальванические элементы, и вторичные – аккумуляторы.
Для получения электрического тока Ox/Red процессы должны быть пространственно разделены и система замкнута. Процесс окисления протекает на аноде (на электроде с более электроотрицательным потенциалом), восстановление – на катоде (на электроде с более электроположительным потенциалом). Название электродов определяются протекающими на них процессами.
ЭДС ХИТ равна разности потенциалов катода – (jk) и анода – (ja). При отсутствии тока в цепи: ЭДС = jk0 – ja0.
В процессе работы ХИТа его ЭДС может уменьшаться, что вызвано изменением потенциалов катода и анода при протекании электрического тока из-за поляризации электродов. Процесс уменьшения поляризации называется деполяризацией.
jk0, ja0 – потенциалы электродов без тока; 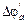 – смещение потенциала анода в положительную область;
– смещение потенциала анода в положительную область; 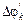 – смещение потенциала катода в отрицательную область под током. ЭДС0 = jk0 – ja0; ЭДС’=
– смещение потенциала катода в отрицательную область под током. ЭДС0 = jk0 – ja0; ЭДС’= 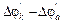 ; Епол=Dja+Djk. Напряжение гальванического элемента U<ЭДС из-за поляризации электродов и омических потерь. Напряжение ХИТ или напряжение на клеммах при электролизе представляет алгебраическую сумму:
; Епол=Dja+Djk. Напряжение гальванического элемента U<ЭДС из-за поляризации электродов и омических потерь. Напряжение ХИТ или напряжение на клеммах при электролизе представляет алгебраическую сумму:
U = ±[( 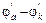 )+I(r1+r2)] (14.2)
)+I(r1+r2)] (14.2)
Знак «–» перед уравнением относится к ХИТ, а «+» к электролизу, r1 и r2 – сопротивление проводников 1-го и 2-го рода. При замыкании цепи I = 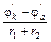 значительно меньше, чем I1 =
значительно меньше, чем I1 = 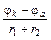 , r1+r2=const. Следовательно основная причина неравенства I<I1 вызвана изменением jk и ja при прохождении тока. Подробно гальванические элементы рассмотрены в «Практикуме». Здесь же мы проиллюстрируем как записывается на «электрохимическом языке» работа и устройство элемента Якоби–Даниэля.
, r1+r2=const. Следовательно основная причина неравенства I<I1 вызвана изменением jk и ja при прохождении тока. Подробно гальванические элементы рассмотрены в «Практикуме». Здесь же мы проиллюстрируем как записывается на «электрохимическом языке» работа и устройство элемента Якоби–Даниэля.
А Zn½ZnSO4½½CuSO4½Cu К
CuSO4 + Zn = ZnSO4 + Cu; Cu2++ SO42– + Zn0 = Zn2+ + SO42– + Cu0
окис: Zn – 2  ® Zn2+
® Zn2+
восcт: Cu2+ + 2  ® Cu
® Cu
Cu2+ + Zn0 = Zn2+ + Cu0
Отметим дополнительно, как устроен концентрационный гальванический элемент (у которого электроды одни и те же, но концентрация электролита в при электродном пространстве разная).
Ag (I)½AgNO3½½AgNO3½Ag (II) C1<<C2
А.: Ag –  ® Ag+ (I)
® Ag+ (I)
К.: Ag+ +  ® Ag0 (II)
® Ag0 (II)
Нетрудно убедиться, используя уравнение Нернста, что возникнет разность потенциалов.
Условия, необходимые для построения любого гальванического элемента: 1) наличие проводников 1-го рода (металлы) и 2-го рода (электролиты) (электронная и ионная проводимость); 2) возможность разделения системы электродов на две неравноценные части, т.е. разделены мембраной или электролитическим ключом.
Работа и устройства гальванических элементов, а также аккумуляторов и топливных элементов приведены в «Практикуме». Отметим лишь, что в аккумуляторах возможно протекание двух противоположно направленных процесса: выработка электрической энергии за счет окислительно-восстановительной реакции, протекающей на электродах, или разрядка и противоположный – зарядка, а по сути – электролиз. Должно быть понятным, что необходимым условием работы аккумулятора является обратимость процесса, чему удовлетворяют реакции диспропорционирования(например, 2PbSO4 + 2H2O ⇄ PbO2 + Pb + 2H2SO4) и неизменность концентрации ионов на электродах, последнее достигается когда ионы входят в состав труднорастворимых соединений.
Топливные элементы (электрохимические генераторы), в основе работы которых лежит реакция окисления топлива на электродах. Простейший и самый значимый топливный элемент основан на реакции окисления водорода кислородом: 2H2 + O2 = 2H2O. Его схему работы можно записать
H2, M½KOH½M, O2
M – проводник первого рода (токоотвод).
A.: 2ОН–+Н2 – 2  = 2H2O
= 2H2O
K.: 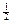 О2 + H2O + 2
О2 + H2O + 2  = 2ОН–
= 2ОН–
H2 + ½O2 = 2H2O
В результате протекания этой реакции в цепи генерируется постоянный ток и химическая энергия превращается в электрическую.
§ 3. Электролиз. ОВР, протекающие на электродах при прохождении через электролит электрического тока – электролиз. Для осуществления электролиза необходимы: 1) источник постоянного тока (стационарный электролиз);
2) электролит – водный раствор или расплав; 3) электроды.
Электрод, соединенный с отрицательным полюсом источника тока называется катод, на нем идет процесс восстановления (присоединения электронов), находящихся в растворе ионов металла или ионов водорода (как восстановление воды). Катод является лишь передатчиком электронов. Электрод, соединенный с положительным полюсом источника тока, называется анодом, на нем происходит процесс окисления (отдача электронов). Аноды бывают: растворимые и нерастворимые, инертные, они служат для отвода электронов. В качестве нерастворимых анодов используются графит, уголь, Pt. На аноде: выделяется анион электролита (2Cl–– 2  ® Cl2), окисление воды (2H2O – 4
® Cl2), окисление воды (2H2O – 4  ® О2 + 4Н+), или ионов гидроксила (4ОН– – 4
® О2 + 4Н+), или ионов гидроксила (4ОН– – 4  ® 2H2O + О2).
® 2H2O + О2).
Количественные законы электролиза были установлены Фарадеем.
Первый закон. Масса веществ, выделившихся при электролизе на электродах, пропорциональна количеству прошедшего через раствор электричества и не зависит от его концентрации и температуры
m = k×q или m = k×I×t (14.3)
где m – масса металла, г; k – электрохимический эквивалент; I – сила тока, А;
t – время электролиза, с; q – количество электричества = I×t. Электрохимическим эквивалентом металла называется его масса, выделяющаяся на электроде при прохождении 1 кулон электричества, и характеризует природу металла.
Второй закон. Равные количества электричества выделяют при электролизе массы веществ, пропорциональные их химическим эквивалентам:
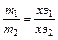 , тогда объединенный закон:
, тогда объединенный закон: 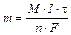 (14.4)
(14.4)
где М– молекулярная масса; n– валентность металла; хэ = М/n;
F – число Фарадея.
Из объединенного закона Фарадея следует, что nF– количество электричества, необходимое для выделения 1 моль атома металла или генерируемое гальваническим элементом при растворении такого же количества металла. Работа электрического тока (А), генерируемого в ХИТ при растворении 1 моль металла, равна А = nFE, где E = ЭДС ХИТ.
При расчетах электролиза вводится понятие плотность тока i – это отношение силы тока I к площади образца S
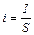 (14.5)
(14.5)
Наименьшее напряжение, при котором начинается процесс электролиза, называется напряжением разложения (U) данного электролита при данных условиях. Теоретически для электролиза достаточно было бы напряжения, равного ЭДС ХИТ., составленного из этих электродов, но имеющего противоположное направление, но на практике напряжение разложения больше, чем ЭДС ХИТ. Разность между напряжением, фактически необходимым для электролиза, и ЭДС ХИТ, называется перенапряжением (поляризацией) при электролизе (h)
h = U – ЭДС (14.6)
где U – напряжение разложения; ЭДС – ХИТ, отвечающего этой системе.
Выделительным потенциалом называется тот минимальный потенциал, при котором начинается фактический разряд ионов, который на величину перенапряжения превышает равновесный потенциал.
Любая электрохимическая реакция протекает минимум в 3 стадии: а) подвод реагентов к электроду; б) собственно электрохимическая реакция; в) отвод продуктов реакции от электродов.
Возникновение поляризации обусловлено замедленностью отдельных стадий процесса. В зависимости от характера замедленной стадии возникает концентрационная или электрохимическая поляризация. Концентрационная поляризация вызвана разностью концентраций ионов в объеме и приэлектродном слое (а, б – стадии). Изменение потенциала, обусловленное замедленностью электрохимической реакции (б), называется электрохимической поляризацией или перенапряжением – это превышение потенциала разряда ионов над нормальным потенциалом в равновесных условиях. Количественно связь между h и i выражается формулой Тафеля:
h = ±(а + bi) (14.7)
где h – перенапряжение; a, b – константы, зависят от природы материала, температуры.
Наиболее полно h изучено для ионов Н+ h 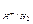 и отвечает процессу 2Н++2
и отвечает процессу 2Н++2  =Н2 на катоде; jк смещается в (–)-область под током. Перенапряжению кислорода h
=Н2 на катоде; jк смещается в (–)-область под током. Перенапряжению кислорода h 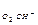 отвечает процесс 4ОН––4
отвечает процесс 4ОН––4  ®2H2O+О2 и jа' смещается в (+) область.
®2H2O+О2 и jа' смещается в (+) область.
§ 4. Электродные процессы при электролизе. Катодные процессы. Последовательность катодных процессов диктуется закономерностями Ox/Red реакций. На катоде первоначально разряжается тот ион, который характеризуется наиболее электроположительным потенциалом, т.е. наиболее сильные окислители. Все окислители условно можно разделить на 3 группы в соответствии с расположением металлов в ряду электрохимической активности j0 стандартных потенциалов. При электролизе водных растворов солей металлов, расположенных правее водорода (jМе>j 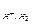 ) на катоде восстанавливаются ионы металла (Cu2++2
) на катоде восстанавливаются ионы металла (Cu2++2  ®Cu), Вторая группа металлов расположена левее H2 до Mn, на катоде возможно одновременное восстановление и Н2 (или Н2О), и иона металла. Здесь необходимо учитывать h
®Cu), Вторая группа металлов расположена левее H2 до Mn, на катоде возможно одновременное восстановление и Н2 (или Н2О), и иона металла. Здесь необходимо учитывать h 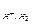 и зависимость j
и зависимость j 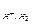 от рН. Третья группа металлов расположена левее Mn, при электролизе их можно получить только из расплавов.
от рН. Третья группа металлов расположена левее Mn, при электролизе их можно получить только из расплавов.
Последовательность анодных процессов при электролизе также диктуется закономерностями ОВР. Возможны следующие реакции:
1) растворение металла Me – n  ® Men+;
® Men+;
2) образование оксидных покрытий Me2+ + 2ОН– ® MeО¯+ Н2О;
3) окисление анионов или Н2О.
На аноде первоначально протекает процесс, который характеризуется наименьшей величиной потенциала. При электролизе водных растворов с нерастворимым анодом необходимо руководствоваться рядом окисления анионов. При электролизе солей водных растворов бескислородных кислот разряжаются ионы I–, Br–, Cl–, а не молекулы Н2О. При электролизе солей, содержащих анионы NO3–, CO42–, PO43– на аноде окисляются молекулы Н2О или ОН–из-за высокого перенапряжения кислороды (h 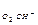 ).
).
Рассмотрим электролиз водного раствора NaCl, рН=7. Анод нерастворимый.
К.: 2H2O + 2  ®H2+2OH–
®H2+2OH–
А.: 2Cl–– 2  ®Cl2 (потенциал меньший), 2OH– – 2
®Cl2 (потенциал меньший), 2OH– – 2  ®H2O+O
®H2O+O
При электролизе расплава NaCl (графитовые электроды) идет разложение NaCl = Na+ + Cl–, под током:
К.: Na– +  ® Na0 – восстановление
® Na0 – восстановление
А.: 2Cl– – 2  ® Cl2 – окисление.
® Cl2 – окисление.
Значение электролиза трудно переоценить, он имеет многочисленные и значительные прикладные аспекты (прикладная электрохимия): гальванотехника, гальваностегия, гальванопластика, электроэкстракция и др. Но это является предметом отдельного курса.
Лекция 15
КОРРОЗИЯ МЕТАЛЛОВ И ЗАЩИТА ОТ КОРРОЗИИ
Технически нецелесообразное разрушение металлов под воздействием внешней среды называется коррозией. Причиной коррозии металлов является их термодинамическая неустойчивость, т.е. возможность самопроизвольного перехода металла в более устойчивое окисленное состояние, в котором он встречается в природе. Химическая энергия реакции коррозионного разрушение металлов выделяется в виде теплоты и рассеивается в окружающем пространстве. Коррозионные процессы протекают необратимо в соответствии со вторым началом термодинамики и являются ОВ-процессами.
Убытки от коррозии делятся на: а) прямые, т.е. стоимость металла, подвергшегося коррозионному разрушению; б) косвенные, которые значительно могут превышать прямые потери.
К убыткам от коррозии можно отнести стоимость потерянного продукта, например, газа, нефти, масла через прокоррозировавшие трубы, экологический урон и т.д. Ежегодные потери от коррозии исчисляются многими миллиардами рублей.
По условиям протекания различают следующие виды коррозии:
1) газовая (при высоких температурах);
2) коррозия в неэлектролитах (органических средах, не проводящих электрический ток);
3) атмосферная коррозия в естественной атмосфере воздуха;
4) коррозия в электролитах (кислотная, щелочная, солевая, морская, в расплавах);
5) почвенная коррозия (ржавление подземных трубопроводов);
6) структурная коррозия из-за структурной неоднородности металла;
7) биокоррозия при участии продуктов, выделяемых микроорганизмами;
8) радиационная коррозия;
9) контактная коррозия, вызванная контактом металлов, имеющих разные потенциалы в данном электролите;
10) коррозионная кавитация – разрушение металла при одновременном коррозионном и ударном воздействии внешней среды (разрушение лопаток гребных винтов морских судов).
По характеру коррозионного разрушения (по геометрии) различают:
1. Сплошная или общая коррозия, ее условно подразделяют на:
а) равномерная, она протекает примерно с одинаковой скоростью по всей поверхности металла;
б) неравномерная – протекает с неодинаковой скоростью на различных участках поверхности металла;
в) структурно-избирательная коррозия, при которой разрушается преимущественно одна структурная составляющая сплава (обесцинкование латуни).
2. Местная коррозия, охватывающая лишь некоторые участки поверхности металла:
а) пятнами (латунь в морской воде);
б) язвами (коррозия стали в грунте);
в) точечная (питтинг) точек 0,1-2 мм (нержавеющая сталь в морской воде);
г) сквозная (сквозное разрушение металла);
д) подповерхностная начинается с поверхности, но распространяется под поверхностью (луженое железо);
е) межкристаллитная (интеркристаллитная) коррозия распространяется оп границам кристаллов. Этот вид особенно опасен, т.к. ведет к быстрой потере прочности и пластичности.
По механизму протекания коррозионного процесса как ОВР, зависящему от характера внешней среды различают:
а) химическую коррозию;
б) электрохимическую коррозию.
Скорость коррозии зависит от: характера среды, состояния поверхности, температуры и других факторов.
§ 1. Химическая коррозия.При химической коррозии металл разрушается за счет химической реакции в средах, не проводящих электрический ток. Это коррозия в газах и парах при высокой температуре в отсутствии влаги (газовая коррозия) или в жидкостях, не проводящих электрического тока (в неэлектролитах). Химическая коррозия возможна, если DG<0.
Химическую коррозию в атмосфере кислорода в общем виде можно представить как:
nMe + 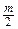 O2 = MenOm (15.1)
O2 = MenOm (15.1)
Скорость окисления металла зависит от скорости собственно химической реакции и скорости диффузии окислителя через окисную пленку. Защитное действие пленки тем выше, чем лучше ее сплошность и ниже диффузионная способность.
Сплошность пленки на поверхности металла оценивается фактором Пиллинга-Бедвордса – VOX /VМе, где VOX – объем образовавшегося оксида; VМе – объем металла, израсходованного на образование этого оксида.
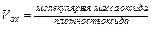 (15.2)
(15.2)
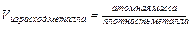 (15.3)
(15.3)
Если VOX /VМе<1, пленка не может быть сплошной и защищать металл от коррозии. Такая закономерность наблюдается для щелочных и щелочноземельных металлов. Отмечается линейный закон роста пленки:
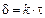 , (15.4)
, (15.4)
где d – толщина пленки; k – константа; t – время образования окисной пленки.
Если VOX /VМе>1, то пленка сплошная, коррозия будет тормозиться диффузией реагентов через пленку и по мере утолщения оксида рост ее будет замедляться. В этом случае рост пленки соответствует параболическому закону
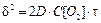 , (15.5)
, (15.5)
где D – коэффициент диффузии; С[О2] – концентрация кислорода.
Характерно для таких металлов как Fe, Co, Ni, Mn, Ti.
Для таких металлов как Al, Zn, Cr установлена логарифмическая зависимость роста пленки во времени (12.5) и VOX/VМе>1 пленки тонкие, сплошные.
δ = k ln τ (15.6)
В зависимости от температуры для одного и того же окисляющегося металла могут проявляться различные законы роста оксидной пленки.
При химической коррозии окисление и восстановление происходят одновременно, в одну стадию без «территориального» разделения.
§2. Электрохимическая коррозия подчиняется законам электрохимической кинетики гетерогенных реакций. Она протекает в средах, проводящих электрический ток: во влажной атмосфере с растворенными в ней газами, в растворах электролитов; в почве и расплавах солей. Термодинамическая возможность электрохимической коррозии с кислородной и водородной деполяризацией определяется прежде всего электрохимической диаграммой воды и наличием гальванической пары элементов (г.э.).
Согласно теории микрогальванопар (Де ля Рив), причиной электрохимической коррозии металлов является наличие на их поверхности микроскопических короткозамкнутых гальванических элементов, возникающих вследствие неоднородности металла и его контакта с окружающей средой. В отличие от специально изготовляемых в технике г.э. они возникают на поверхности металла самопроизвольно.
Электрохимическое растворение металла состоит из трех основных стадий:
1) анодного процесса – окисление Ме – nе– = Меn+ – перехода ионов коррозирующего металла в раствор под влиянием гидратации (сольватации) с освобождением электронов;
2) омического процесса – перетекания освободившихся электронов от анодных участков к катодным (поляризация);
3) катодного процесса – ассимиляции освободившихся электронов каким-либо деполяризатором, находящимся в растворе.
На анодном участке, потенциал которого электроотрицательнее, происходит растворение металла:
Men+×n  + mH2O = Men+×mH2O + n
+ mH2O = Men+×mH2O + n 
| электронейтральный атом на поверхности анода | гидратиро-ванный ион в растворе | освободившиеся электроны на аноде |
Часть освободившихся электронов перейдет с анода на катод. Происходит поляризация электродов в результате чего jК и jА сближаются, что препятствует протеканию коррозионного процесса. Однако в растворе всегда имеются ионы или вещества (деполяризаторы), которые способны отводить электроны с катодных участков. Процесс отвода электронов, с катодных участков называется деполяризацией. Следовательно, электрохимическая коррозия может протекать, если электроны с анодных участков постоянно перетекают на катодный, а с катодного удаляются деполяризаторами.
Очень часто электрохимическая коррозия возникает в результате различной аэрации, т.е. неодинакового доступа кислорода воздуха к отдельным участкам поверхности металла. При коррозии железа под каплей электролита около ее краев, куда кислороду легче проникнуть будет катодный участок, а в центре капли, где толщина капли больше и О2 проникнуть труднее – анодный участок – происходит разрушение металла.
Коррозия железа проходит в две стадии: Fe0 ® Fe2+ ® Fe3+
Дата добавления: 2015-08-11; просмотров: 578;
