Основы кристаллохимии
Большинство твердых тел являются кристаллическими. Кристаллы отличаются от аморфных тел симметрией кристаллической решетки, анизотропностью и постоянной температурой плавления.
Симметрия внешней формы кристалла отражает симметрию его внутренней структуры, т.е. правильную периодическую повторяемость расположения частиц, составляющих кристалл. Регулярное расположение частиц в кристалле изображается в виде пространственной кристаллической решетки, представляющей собой сетку из регулярно повторяющихся в пространстве точек, называемых узлами решетки. В узлах показано положение частиц, формирующих кристалл. Чтобы описать структуру кристалла, достаточно знать небольшую часть кристаллической решетки, называемую элементарной ячейкой, обладающей всеми элементами симметрии, присущими кристаллической решетке (рис. 18.1).
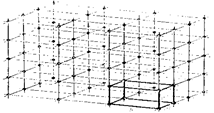
Рис. 18.1. Пространственная решетка с наклонными произвольными
координатами. Видна элементарная ячейка с тремя ребрами – а, b, c.
В отличие от аморфных тел кристаллы отличаются анизотропными свойствами, т.е. величина того или другого параметра в кристалле будет различной в направлении его разных осей. Переход из кристаллического твердого в жидкое состояние осуществляется скачкообразно при постоянной температуре, называемой температурой плавления.
Элементами симметрии кристалла являются плоскости, оси и центр симметрии.
Плоскость симметрии делит фигуру на две части, расположенных друг относительно друга как предмет и его зеркальное отражение. Например, в кубе три координатных плоскости и шесть диагональных плоскостей (некоторые из них представлены на рис. 18.2).
Осью симметрии называется прямая линия, при повороте вокруг которой
на некоторый угол фигура совмещается сама с собой. Порядок оси симметрии – n – показывает, сколько раз фигура совмещается сама с собой при полном
повороте вокруг оси симметрии. Так, у куба три оси 4-го порядка (L4), которые проходят через центры противоположных граней, четыре оси 2-го порядка (L3),
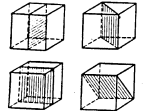 Рис. 18.2. Некоторые из плоскостей симметрии куба.
Рис. 18.2. Некоторые из плоскостей симметрии куба.
| 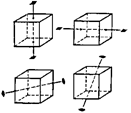 Рис. 18.3. Некоторые из осей симметрии куба.
Рис. 18.3. Некоторые из осей симметрии куба.
|
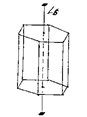 Рис. 18.4. Единичное направление L6 в гексагональной призме.
Рис. 18.4. Единичное направление L6 в гексагональной призме.
| 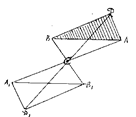 Рис. 18.5. Центр симметрии – точка С.
Рис. 18.5. Центр симметрии – точка С.
|
являющихся пространственными диагоналями куба и шесть осей 2-го порядка (L2), проходящих через середины пар противоположных ребер (рис. 18.3). Единственное, не повторяющееся в многограннике направление, называется единичным направлением. Например, в гексагональной призме единичным направлением является ось 6-го порядка (L6) – рис. 18.4.
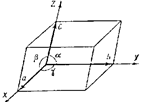 Рис. 18.6. Косоугольные координаты и параметры элементарной ячейки.
Рис. 18.6. Косоугольные координаты и параметры элементарной ячейки.
| Центром симметрии называется особая точка внутри фигуры, характеризующаяся тем, что любая прямая, проведенная через нее, встречает одинаковые точки фигуры по обе стороны от центра на одинаковых расстояниях от него (рис. 18.5). Элементарную ячейку изображают, в общем случае, в косоугольной системе |
координат. Трехмерная система координат выбирается в соответствии с симметрией кристалла. Оси координат выбираются либо по осям симметрии, либо по ребрам кристаллического многогранника. Важнейшими параметрами кристалла являются размеры элементарной ячейки, их определяют как равновесные расстояния в направлении характеристических осей между центрами частиц, занимающих соседние узлы решетки, и называют постоянными решетки. Принятые в кристаллографии косоугольные координаты и параметры элементарной ячейки показаны на рис. 18.6. Это размеры ребер a, b, c и углы между ребрами a, b, g.
Классификация кристаллов по симметрии. Элементы симметрии обнаруживаются в кристаллах в различных сочетаниях. В 1890 г. Е.С. Федоров провел расчет всех возможных сочетаний элементов симметрии и установил, что число устойчивых сочетаний равно 230. По-видимому, этой цифрой исчерпывается все многообразие возможных кристаллических структур в природе. Более ста лет назад А. Бравэ показал, что существует 14 типов элементарных ячеек. Таким образом, кристаллы многих веществ имеют сходную пространственную структуру.
Из чисто геометрических соображений согласно Браве достаточно 14 элементарных ячеек, чтобы описать строение всех кристаллов независимо от состава и природы частиц (узлов).
Простейшая классификация предполагает подразделение кристаллов на семь сингоний (слово «сингония» означает сходноугольность). В сингонии объединяются кристаллы, для которых одинакова симметрия элементарных ячеек и система осей координат. На рис. 18.7 приведены формы элементарных ячеек, соответствующие семи сингониям.
| Рис. 18.7. Основные кристаллические сингонии: а – кубическая (a = b =c, α=β=g=90°); б – тетрагональная (а = b ¹ с, α=β=g=90°); в – гексагональная (а = b ¹ с, a=b=90°, g=120°); г – ромбоэдрическая (а = b = с, a=b=g¹90°); д – орторомбическая (а ¹ b ¹ с, a=β=γ=90°); е – моноклинная (а ¹ b ¹ с, a=γ=90°, β¹90°); ж – триклинная (а ¹ b ¹ с, a¹b¹g¹90°). | 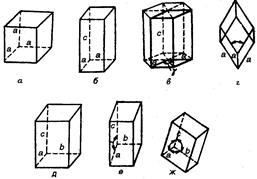
|
Координационные числа и координационные многогранники. Координационным число (к.ч.) атома или иона называется число ближайших однотипных соседних атомов в кристаллической структуре.
| Если центры ближайших атомов соединить друг с другом, то получится координационный многогранник (к.м.). Атом, для которого строится к.м. находится в центре многогранника. Представленные на рис. 18.8 координационный многогранник (к.м.) соответствуют расположению атомов в соединениях бериллия, бора, углерода, для которых имеет место sp, sp2, sp3-гибридизация, а также положение атомов в структуре меди (кубооктаэдр). | 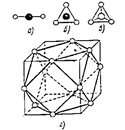 Рис. 18.8. Координационные многогран-ники: а – гантель, б – треугольник, в – тетраэдр, г – кубооктаэдр.
Рис. 18.8. Координационные многогран-ники: а – гантель, б – треугольник, в – тетраэдр, г – кубооктаэдр.
|
Типы кристаллических структур по характеру химических связей. Многие физико-химические свойства кристаллических веществ определяются типом химической связи между частицами, образующими кристалл. Кристаллы подразделяются на металлические, ковалентные, ионные и молекулярные. При этом важной характеристикой кристаллических веществ становится энергия кристаллической решетки – Екрист. Это энергия, которую надо затратить на разрушение данного кристалла и удаление его частиц за пределы их взаимодействия. Ее измеряют в кДж и рассчитывают на 1 моль вещества.
Металлические кристаллы. Металлическая связь. Характерными свойствами металлов являются высокая электропроводность и теплопроводность, твердость, ковкость, способность к пластической деформации, термоэлектронная эмиссия, металлический блеск и др.
В химических реакциях металлы проявляют восстановительные свойства: Me – ne ® Men+.
Специфичность физико-механических и химических свойств металлов обусловлена сходной электронной структурой их атомов, и, как следствие, характерным кристаллохимическим строением.
Для атомов металлов характерно небольшое число валентных электронов и большое число вакантных (незаполненных) орбиталей во внешнем квантовом слое. Вследствие малой плотности электронов на внешних уровнях, атомы металлов в процессе кристаллизации легко сближаются и обобщают валентные электроны. Валентные электроны участвуют в образовании связи сразу с восемью или двенадцатью соседними атомами, каждый из которых, в свою очередь, входит в соседнюю группировку, насчитывающую такое же количество атомов. В этих условиях валентный электрон с небольшой энергией ионизации свободно перемещается по доступным орбиталям всех соседних атомов, обеспечивая связь между ними, т.е. является нелокализованным. Такая нелокализованная химическая связь в металлических кристаллах называется металлической связью.
Металлическая связь – многоцентровая химическая связь с дефицитом валентных электронов в твердом или жидком веществе, основанная на обобществлении электронов внешнего квантового уровня атомов.
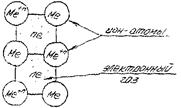 Рис. 18.9. Кристаллическая решетка металлов.
Рис. 18.9. Кристаллическая решетка металлов.
| Для описания металлической связи часто используют модель «свободного электрона». Согласно этой модели в узлах кристаллической решетки находятся положительные ионы металла, «погруженные» в электронный газ из нелокализованных валентных электронов (рис. 18.9). Устойчивость кристалла обеспечивается силами притяжения между положительными ионами и электронным газом. Теория свободного электрона объясняет |
некоторые свойства металла. Так, ненаправленный характер связей положительных ионов с электронным газом объясняет высокую ковкость и тягучесть металлов. По этой же причине металлы кристаллизуются в структурах плотнейших упаковок.
Металлическая связь не исключает некоторой доли ковалентности. Металлическая связь в чистом виде характерна только для щелочных и щелочноземельных металлов. Установлено, что у переходных металлов лишь небольшая часть валентных электронов находится в состоянии обобществления. Остальные же электроны осуществляют направленные ковалентные связи между соседними атомами. Перекрывание направленных электронных облаков наблюдается уже в простых sp-металлах, но особенного развития достигает в переходных d-металлах. Это объясняется большими размерами и сложной геометрией d-электронных облаков. В связи с этим, принято считать, что в узлах кристаллической решетки металлов находятся ион-атомы, а валентные электроны – в пространстве между узлами кристаллической решетки.
Направленный характер металлической связи обеспечивает для металлов возможность формироваться в структурах плотнейших упаковок.
В кристаллах, образованных сферическими частицами одного размера плотнейшая упаковка может осуществляться в виде двух энергетически равноценных структур: гексагональной плотнейшей упаковке (ГПУ), гранецентрированной кубической (ГЦК) и объемно-центрированной кубической (ОЦК) (рис.18.10).
| Рис. 18.10. Изображение упаковки шаров и типы металлических структур: а – гексагональная; б – кубическая гранецентрированная; в – кубическая объемно-центрированная. | 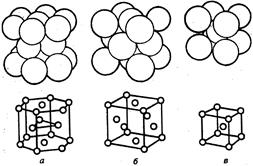
|
Плотность упаковки оценивается коэффициентом компактности:
Kn = 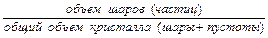
Для плотнейших упаковок ГЦК и ГПУ Kn = 74%.
ОЦК структура не относится к плотнейшим упаковкам, Kn = 8, т.е. это более рыхлая структура, чем ГЦК и ГПУ. В ОЦК структуре кристаллизуются щелочные и щелочноземельные металлы и тугоплавкие металлы (Cr, Mo, W).
В ГЦК структуре кристаллизуется Cu, Au, Ag, Ni, Al, Ca и др.
В ГПУ структуре кристаллизуется Ca, Be, Fe, Ti, Ni, Cu и др. металлы.
Ковалентные кристаллы. Структурными единицами в ковалентных кристаллах являются атомы одного или нескольких элементов, связь между которыми носит ковалентный характер. Ковалентные кристаллы немногочисленны: алмаз, кремний, германий, серое олово, а также кристаллы кварца, карбида кремния, сульфида цинка, нитрида бора. Энергия кристаллической решетки составляет 200-500 кДж/моль. Так, для алмаза – Екрист=480 кДж/моль. Вследствие высокой энергии кристаллической решетки ковалентные кристаллы обладают высокой твердостью и высокой температурой плавления. В связи с направленным характером ковалентной связи ковалентные кристаллы не образуют плотнейшие упаковки. Примером ковалентной решетки служит решетка алмаза (рис. 18.11).
Тип ячейки ГЦК. Атомы углерода занимают все узлы ГЦК, а также центры четырех из восьми октантов куба (рис. 18.12). Причем незаполненные и заполненные октанты чередуются в шахматном порядке. К.ч. равно 4, к.м. – тетраэдр.
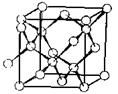 Рис. 18.11 Кристаллическая решетка алмаза.
Рис. 18.11 Кристаллическая решетка алмаза.
| 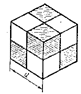 Рис. 18.12. Деление куба на октанты.
Рис. 18.12. Деление куба на октанты.
|
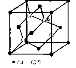 Рис. 18.13. Структура сфалерита.
Рис. 18.13. Структура сфалерита.
| Структура сфалерита – ZnS – алмазоподобна. Отличие от структуры алмаза заключается в том, что атомы одного элемента (Zn) занимают центры граней и вершины куба, а атомы другого элемента (S) – центры четырех из восьми октантов куба (рис. 18.13). |
Ионные кристаллы образуют соединения с ионной связью. Природу ионной связи, структуру и свойства ионных соединений объясняют с позиции электростатической теории химической связи. В рамках этой теории химическое взаимодействие трактуется как процесс образования ионов и последующего их электростатического взаимодействия.
Способность элементов образовывать простые ионы обусловлена электронной структурой их атомов. Эту способность можно оценить величиной энергии ионизации и сродства к электрону. Понятно, что легче всего образуют катионы элементы с малой энергией ионизации: щелочные и щелочноземельные металлы. Образование в условиях обычных химических превращений простых катионов других элементов маловероятно, т.к. это связано с затратой большой энергии на ионизацию атомов.
Простые анионы легче всего образуют р-элементы VII группы вследствие их высокого сродства к электрону. Присоединение одного электрона к атомам О, S, C сопровождается выделением энергии. Присоединение же последующих электронов с образованием свободных многозарядных простых анионов места не имеет. Ионные соединения легче всего образуются при взаимодействии щелочных металлов с галогенами. Однако и в этом случае электронная плотность между ионами не равна нулю, поэтому можно говорить лишь о преимущественном проявлении ионной связи. Радиусы многозарядных ионов представляют собой условные величины.
Ионы можно представить как заряженные шары, силовые поля которых равномерно распределяются во всех направлениях в пространстве. Поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении. Иначе говоря, ионная связь характеризуется ненаправленностью. Взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. Поэтому у иона сохраняется способность притягивать ионы противоположного знака и по другим направлениям. Ионная связь характеризуется ненасыщаемостью.
К.ч. ионных кристаллов определяется соотношением размеров ионов. При соотношении ионных радиусов в пределах 0,41-0,73 имеет место октаэдрическая координация ионов, при соотношении 0,73-1,37 – кубическая координация. Например, соотношение значений радиусов иона Na+ и иона Cl–, равной 0,54 и, соответственно, возникает октаэдрическая координация. Соотношение размеров ионов Cs+ и Cl– равно 0,91, что соответствует кубической координации (рис. 18.14). Подобная взаимная координация ионов достигается в соответствующих кристаллических решетках: простой кубической NaCl и объемноцентрированной кубической CsCl (рис. 18.15).
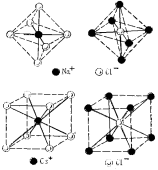 Рис. 18.14. Взаимная координация ионов в кристаллах NaCl и CsCl.
Рис. 18.14. Взаимная координация ионов в кристаллах NaCl и CsCl.
| 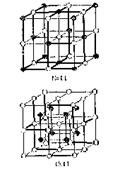 Рис. 18.15. Структура кристаллов NaCl и CsCl.
Рис. 18.15. Структура кристаллов NaCl и CsCl.
|
Энергия кристаллической решетки достигает больших значений. Так для ВеО она составляет 4530 кДж/моль, а для NaCl – 770 кДж/моль. В связи с этим, ионные кристаллы имеют высокую прочность и высокую температуру плавления, однако являются очень хрупкими структурами.
Для ионных соединений понятие простых двухионных молекул типа NaCl и CsCl теряет смысл, весь кристалл можно рассматривать как гигантскую молекулу, состоящую из огромного числа ионов.
Энергия кристаллической решетки (или ионной связи, напомним, что она реализуется в ионных кристаллах) расчитывают в соответствии с законом Кулона и поправкой на множественность, противозарядность и симметрию расположения ионов (константа Маделунга).
Между противоположно заряженными ионами действуют кулоновские силы электростатического притяжения, а на очень малых расстояниях – силы отталкивания заполненных электронных оболочек ионов.
Для двух противоположно заряженных ионов энергию взаимодействия можно выразить по формуле Макса Борна:
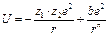 , (18.1)
, (18.1)
где первый член уравнения характеризует силы притяжение Епр., а второй член – силы отталкивания Еотт., z1 и z2 – заряды катиона и аниона, e – заряд электрона, r – расстояние между ионами, b и n – некоторые постоянные величины.
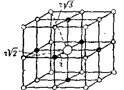 Рис. 18.16. К вычислению постоянной Маделунга.
Рис. 18.16. К вычислению постоянной Маделунга.
| Однако необходимо учитывать силы электростатического взаимодействия каждого иона со всеми ионами в кристалле. Выберем мысленно какой либо ион Na+ в кристаллической решетке поваренной соли (рис. 18.16). Он окружен шестью ионами хлора, отстоящими от него на расстоянии r. |
Следующая группа из двенадцати ионов Na+ будет находиться на расстоянии r 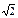 , затем идет группа из восьми ионов Cl– на расстоянии r
, затем идет группа из восьми ионов Cl– на расстоянии r 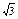 , затем следующие шесть ионов Na+ на расстоянии r
, затем следующие шесть ионов Na+ на расстоянии r 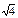 и т.д. Тогда электростатическое притяжение одного моля ионов в кристалле можно описать таким выражением:
и т.д. Тогда электростатическое притяжение одного моля ионов в кристалле можно описать таким выражением:
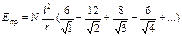 , (18.2)
, (18.2)
где N – число Авогадро.
Очевидно, что сумма в скобках зависит не от зарядов ионов или иных характеристик, а только от взаимного расположения ионов в кристалле, т.е. от структуры кристаллической решетки. Для каждого типа структуры эта сумма является постоянной величиной и носит название константа Маделунга – aМ. Для структур типа NaCl aМ = 1,748, для CsCl (к.ч. = 8) aМ = 1,76. Для структур, имеющих расположение частиц как в кристалле алмаза, например, ZnO (к.ч. = 4) aМ = 1,64. Как видно, изменение KI от 4 до 8 не сильно сказывается на величине константы Моделунга. Но если с.о. ионов разная, то константа Моделунга резко возрастает. Например, в структуре типа CaF2 aМ = 5,039.
Существование структурной постоянной указывает на два важных обстоятельства. Во-первых, взаимодействие для каждого иона в коллективе ионов оказывается всегда более энергетически выгодным, чем в изолированной паре. Это еще показывает происхождение тех движущих сил, которые заставляют ионы собираться в огромные ансамбли и фактически объясняет существование ионных кристаллов.
Во-вторых, суммарное электростатическое поле всех ионов в кристалле создает некоторый дополнительный потенциал, действующий на каждый ион. Этот потенциал усиливает взаимодействие ионов друг с другом в aМ раз.
Молекулярная кристаллическая структура формируется ковалентными молекулами при переходе вещества в конденсированное состояние, которое обусловлено межмолекулярным взаимодействием (силами Ван-дер-Ваальса).
Межмолекулярному взаимодействию приписывают электростатическую природу. Любая молекула – это система, представляющая собой совокупность положительных и отрицательных зарядов (за счет положительно заряженных ядер атомов, электронов, смещения электронной плотности в полярных молекулах и т.п.). Вследствие этого при сближении между молекулами возникают заметные силы притяжения электростатической природы. Наиболее универсально дисперсионное взаимодействие, т.к. оно обусловлено взаимодействием молекул друг с другом за счет их мгновенных микродиполей. При сближении молекул ориентация микродиполей перестает быть независимой и их появление и исчезновение в разных молекулах происходит в такт друг другу. Синхронное появление микродиполей молекул сопровождается их притяжением.
По сравнению с ковалентной связью межмолекулярное взаимодействие очень слабое, на один порядок меньше ковалентной связи. Так, энергия связи Eсв.(Cl2) = 243 кДж, а энергия сублимации (возгонки) кристаллов Cl2 составляет
25 кДж/моль.
В узлах молекулярной кристаллической решетки находятся молекулы. Связь между молекулами осуществляется силами Ван-дер-Ваальса. Структуру молекулярных кристаллов, образованных неполярными молекулами, обуславливает дисперсионное взаимодействие. Поскольку дисперсионные силы ненаправлены и ненасыщаемы, кристаллы, образованные неполярными молекулами, характеризуются высокими координационными числами.
Для соединений, содержащих группировки H-F, O-H, N-H структуру кристаллов определяют водородные связи. Так, одна молекула воды, имеющая две связи О-Н и две направленные электронные пары, может образовать четыре водородные связи. Поэтому в идеальном кристалле льда к.ч. – 4. Поскольку межмолекулярные силы слабы, молекулярные кристаллы легкоплавки, летучи, твердость их невелика.
Итак, различия в типе химической связи в структуре кристаллов определяют существенное отличие физических и химических свойств кристаллических веществ.
Изоморфизм и полиморфизм кристаллических структур.Изоморфизм – это свойство химически и геометрически близких атомов, ионов и их сочетаний замещать друг друга в кристаллической решетке, образуя кристаллы переменного состава. Химически близкими считают атомы с одинаковыми валентностями, типами связи, с равными радиусами или объемами (с отклонением не более 5-7%). Близкие, но не тождественные по составу изоморфные вещества кристаллизуются в одинаковых формах.
Так, например, изоморфны кристаллы дигидрофосфатов и арсенатов щелочных металлов: NaH2PO4 и NaH2AsO4.
Изоморфны кристаллы германия и кремния.
Полиморфизмом называется свойство некоторых веществ существовать в нескольких кристаллических формах, отличающихся по симметрии структуры и по свойствам. Каждая из этих форм, стабильная в определенной области температур и давлений, называется полиморфной модификацией.
Полиморфизм простых веществ принято называть аллотропией. Большинство простых веществ существует в несколько аллотропных модификациях. Аллотропными модификациями углерода является алмаз и графит (рис. 18.11 и рис. 18.17). Общеизвестен пример существования двух модификаций олова: серое a-олово – полупроводник со структурой алмаза и белое b-олово – типичный металл. Полиморфизм чрезвычайно распространен у металлов.
Рис. 18.17. Структура графита.
Прикладные аспекты химии твердых тел вы рассмотрите в следующих курсах.
Рисунки к лекции 3.
Схема экспериментальной установки Резерфорда для исследования рассеивания a-частиц очень тонкой металлической фольгой. Источник – радиактивный Po. Экран – люминисцентный материал или счетчик Гейгера (камера Вильсона).
Ожидаемые результаты эксперимента Резерфорда по рассеиванию a-частиц, основанные на модели атома, предложенной Томсоном (а), и модели атома, к которой пришел Резерфорд (б).
Виды электронных облаков атома водорода в различных квантовых состояниях
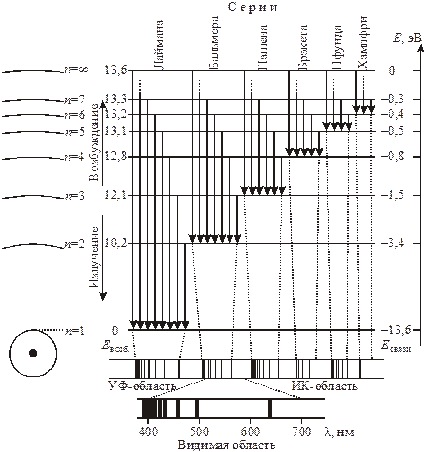
Энергетические уровни и спектр излучения атома водорода.
Диаграмма изотопов ядер. По оси абсцисс отложено содержание в ядре протонов, а по оси ординат – нейтронов. Обычно число нейтронов равно или несколько больше, чем число протонов в ядре, т.е. N³Z. Указаны области значений N и Z, при которых ядра испускают b–-, b+-, или a-частицы.
1 – устойчивые ядра; 2 – естественные изотопы; 3 – искусственные изотопы;
4 – неизвестные изотопы.
Рисунок к лекции 11, 12
Опыт, демонстрирующий осмотическое давление. Мембрана пропускает молекулы растворителя до равновесного состояния с течением времени (t).
Литература
1. Гельфман М.И., Юстратов В.П. Химия. – СПб.: Изд-во «Лань», 2000. – 480 с.
2. Гаршин А.П. Неорганическая химия в схемах, рисунках, таблицах, формулах, химических реакциях. – СПб.: 2000. – 288 с.
3. Коровин Н.В. Общая химия. – М.: Высш. шк., 2003. – 557 с.
4. Харин А.Н. и др. Курс химии. – М.: Высш. шк., 1983. – 511 с.
5. Лучинский Г.П. Курс химии. – М.: Высш. шк., 1985. – 416 с.
6. Фролов В.В. Химия. – М.: Высш. шк., 1986. – 540 с.
7. Ахметов Н.С. Общая и неорганическая химия. – М.: Высш. шк., 1981. – 679 с.; 1988 – 639 с.
8. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии: В 2 т. – М.: Мир, 1982. – Т. 1. 652 с.; Т. 2. 620 с.
9. Зайцев О.С. Общая химия. Состояние веществ и химические реакции. – М.: Химия, 1990. – 352 с.
10. Общая химия. / Под ред. Е.М. Соколовской, Г.Д. Вовченко, Л.С. Гузея. – М.: Изд-во Моск. ун-та, 1980. – 726 с.
11. Угай Я.Л. Общая и неорганическая химия. – М.: Высш. шк., 2002. – 527 с.
12. Глинка Н.Л. Общая химия. – Л.: Химия, 1986. – 703 с.
13. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1983. – 264 с.
14. Практикум по общей химии. / Под ред. А.Н. Глебова – Казань: Экоцентр, 1998. – 152 с.
15. Практикум по общей химии. Ч.1. 3 изд. / Под ред. А.Н. Глебова – Казань: Экоцентр, 2005. – 88 с.
16. Сборник контрольных работ по общей химии. 2 изд. / Под ред. А.Н. Глебова – Казань: Экоцентр, 2003. – 42 с.
Курс лекций по общей химии:
Дата добавления: 2015-08-11; просмотров: 1421;
