Энергия электрона в атоме водорода
Ядром атома водорода является протон — положительно заряженная элементарная частица. По величине заряд протона +е»1,6·10-10 Кл равен заряду электрона. Масса протона в 1837 раз больше массы электрона. Потенциальная энергия электрона в электростатическом поле протона равна
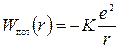 . (2.14)
. (2.14)
Электрон вращается по орбите со скоростью 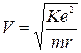 (1.9), поэтому его кинетическая энергия
(1.9), поэтому его кинетическая энергия
 . (2.15)
. (2.15)
Полная энергия электрона в атоме водорода равна
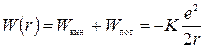 (2.16)
(2.16)
и составляет половину его потенциальной энергии.
Чтобы оторвать электрон от атома водорода, то есть перевести его с первой орбиты r1, в бесконечность, надо затратить работу:
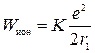 . (2.17)
. (2.17)
Эта работа носит название энергии ионизации атома. Для атома водорода r1=0,58 Å=0,58·10-10 и энергия ионизации равна
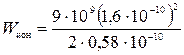 »10-18 Дж. (2.18)
»10-18 Дж. (2.18)
Часто энергии ионизации атомов приводят в расчете на один моль, то есть рассчитывают энергию ионизации атомов, количество которых равно числу Авогадро NA=6·1023 моль-1. Тогда энергия ионизации водорода будет Wион=10-18·1023=6·105 Дж/моль. Это очень большая величина, поэтому в обычных условиях атомы водорода не ионизированы (чтобы нагреть 1 моль воды до кипения, надо 1,8 ккал/моль, а чтобы превратить эту воду в пар, требуется 9,7 ккал/моль).
Зависимость энергии электрона от расстояния до ядра (протона) в атоме водорода показана на рис. 2.5. Энергия отрицательна, так как мы отсчитываем её от «нулевой конфигурации» при r → ∞. Чем дальше от ядра находится электрон, тем больше его энергия. Это означает, что удалить электрон можно, лишь сообщив ему дополнительную энергию.
Согласно квантово-механическим представлениям, радиусы орбит электронов в атоме не могут быть произвольны. Если n – номер орбиты, то радиусы разрешенных орбит имеют определенные дискретные значения rn=r1n2. На рис. 2.5 показаны радиусы
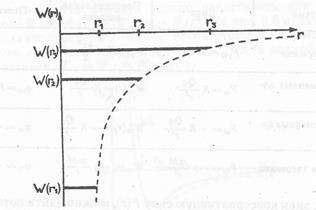
Рис. 2.5. Радиусы орбит и энергетические уровни электрона
в атоме водорода
разрешенных орбит в атоме водорода и энергии электрона на этих орбитах (энергетические уровни). Как видно, вторая орбита находится вчетверо дальше от ядра, чем первая орбита. Радиус третьей орбиты в 9 раз больше первой и т.д. Соответственно энергетические уровни электрона в атоме водорода также дискретны.
Энергия электрона на орбите с номером п равна
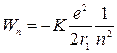 . (2.19)
. (2.19)
При переходе с орбиты номера k на орбиту с номером п излучается энергия
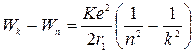 . (2.20)
. (2.20)
В о п р о с: рассчитайте энергию электрона на пятой орбите. Какая энергия излучится при переходе с пятой орбиты на первую?
Электрическую потенциальную энергию заряда q в поле другого заряда Q и гравитационную потенциальную энергию тела массой т в поле тяготения Земли М можно представить следующим образом:
Wэл(r)=φэлq
Wгр(r)=φгрm (2.21)
Величина φ называется потенциалом и характеризует свойства электрического или гравитационного полей.
Таблица 1
Дата добавления: 2015-08-08; просмотров: 1477;
