Силы и потенциалы различных систем
| Система | Сила | Потенциальная энергия | Потенциал |
| Упругая пружина |  Fупр =-kx Fупр =-kx
| 
| |
| Два одноименных заряда | 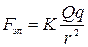
| 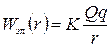
| 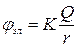
|
| Два разноименных заряда | 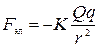
| 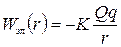
| 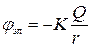
|
| Тело в поле тяготения | 
| 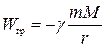
| 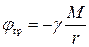
|
Итак, зная консервативную силу F(r), можно найти потенциальную энергию Wпот,(r). Рассмотрим теперь обратную задачу: зная потенциальную энергию Wпот,(r), определим величину силы F(r). Из табл. 1 легко увидеть, что сила равна производной от потенциальной энергии по расстоянию, взятой с обратным знаком:
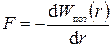 (2.22)
(2.22)
Эта формула является очень полезной и мы часто будем ей пользоваться.
Потенциальная энергия взаимодействия молекул
Взаимодействия между нейтральными (незаряженными) атомами или молекулами называют ван-дер-ваальсовыми взаимодействиями. Природа ван-дер-ваальсовых сил — электрическая. Установлено, что нейтральные атомы и молекулы притягиваются на небольшом расстоянии, но отталкиваются, если их плотнее придвигать друг к другу.
Потенциальная энергия взаимодействия между двумя нейтральными атомами или молекулами описывается формулой Леннард-Джонса:
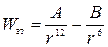 . (2.23)
. (2.23)
Формула Леннард—Джонса — эмпирическая, то есть она не выведена, а подобрана так, чтобы хорошо описывать экспериментальные данные. Характерные постоянные А и В зависят от вида выбранной пары атомов или молекул и приводятся в справочниках (попробуйте сами сообразить, имеют ли размерность постоянные А и В?)
Согласно формуле 2.23 потенциальную энергию двух нейтральных атомов или молекул можно представить как сумму двух членов: W+=A/r12 и W-=-В/r6. На рис. 2.6 пунктиром приведена зависимость W+ и W- от расстояния r между центрами атомов, а сплошной кривой дана зависимость полной потенциальной энергии Wат= W+ +W- от r.
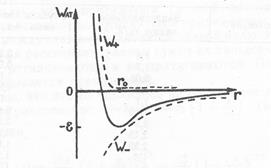
Рис. 2.6. Зависимость потенциальной энергии межмолекулярных взаимодействий от расстояния между центрами атомов
Как видно из рис. 2.6, для потенциальной энергии взаимодействия атомов характерен минимум («потенциальная яма»). «Потенциальная яма» характеризуется глубиной — ε, а расстояние r0 носит название ван-дер-ваальсова радиуса атома (или молекулы). Итак,
Wат(r0) =-ε, (2.24)
Wат(r0) = min. (2.25)
Поскольку в точке экстремума производная функция обращается в ноль, условие 2.25 можно записать в виде
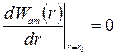 . (2.26)
. (2.26)
Параметры ε и r0 характеризуют природу атома или молекулы (табл. 2). Для большинства атомов величины ван-дер-ваальсовых радиусов r0/2 составляют несколько ангстерм (1Å=10-10м). Глубина «потенциальной ямы» ε, то есть потенциальная энергия атомов при их наиболее благоприятном расположении, обычно невелика. Как правило, она меньше, чем величина кинетической энергии хаотического беспорядочного движения атомов, которая при комнатной температуре составляет 3,7 кДж/моль. Поэтому в обычных условиях большинство нейтральных атомов находятся в газообразном состоянии, то есть не связаны друг с другом.
Таблица 2
Дата добавления: 2015-08-08; просмотров: 1713;
