Условия химического равновесия. Обратимые и необратимые реакции.

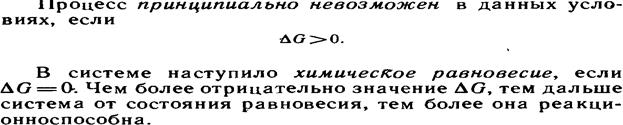
8.4.Константа равновесия и ее связь с термодинамическими функциями.Термодинамический вывод закона действия масс для хим. равновесия
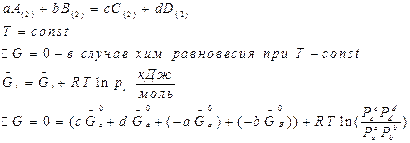
Давления равновесны
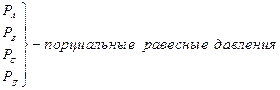
т.к. 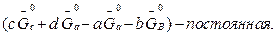
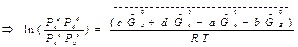
при данной Т – постоянна, можно написать 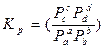
равновесные. Она определяет предел хим. реакции при данной Т- она постоянна 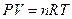 - законы химии позволяют перейти от одной константы к другой.
- законы химии позволяют перейти от одной константы к другой.
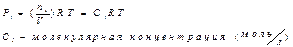
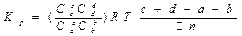
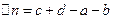 -применение числа молей разнообразных веществ в хим. реакции.
-применение числа молей разнообразных веществ в хим. реакции.
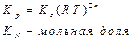
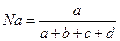 -мольная доля компонента а.
-мольная доля компонента а.
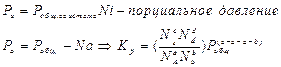
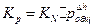
Константа химического равновесия зависит только от температуры.
8.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
1. Определениевероятности протекания реакций в открытой и изолированной системах.
2. Определениетемпературных условий наступления химического равновесия..
Дата добавления: 2015-08-08; просмотров: 1313;
