Упражнения.
1.Рассчитайте при температуре 25о С стандартное изменение свободной энергии Гиббса образования оксида Fе2О3 из соответствующих простых веществ, если известны стандартная энтальпии образования ( 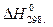 ,кДж/моль) и стандартные энтропия образования(Δ
,кДж/моль) и стандартные энтропия образования(Δ 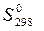 ,Дж/моль·К) данного оксида. Может ли данная реакция протекать самопроизвольно?
,Дж/моль·К) данного оксида. Может ли данная реакция протекать самопроизвольно?
 = -824
= -824
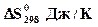 ,ДЖ/мольК= 78
,ДЖ/мольК= 78
2. Поприведенным стандартным значениям изменения энтальпии и энтропии для химической реакции рассчитайте температуру, при которой равновероятны прямое и обратное направления данной реакции. В каком направлении, прямом или обратном, данная реакция будет протекать самопроизвольно при более высоких температурах?
| Реакция | 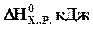
| 
|
| СО2(г)+С(г)=2СО(г) | + 173 | +176; |
Ответы:1-; 2-
Лекция 9. Химическая кинетика: Скорость реакции, химическое равновесие..
Понятие скорости реакции . Зависимость скорости реакции от концентрации реагентов. Зависимость скорости реакции от температуры. Химическое равновесие. Принцип Ле Шателье Фазовое равновесие. Правило фаз.
9.1.Понятие скорости реакци Раздел химии, изучающий скорости и механизмы протекания реакций, называется химической кинетикой. Под скоростью химической реакции понимается изменение количества вещества за какой-то промежуток времени:
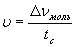 .
.
Различают скорость реакции в гомогенных (однородных) и гетерогенных (неоднородных) системах. В гомогенных системах реакции протекают по всему объему:
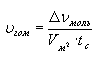 .
.
В гетерогенных системах реакции протекают на границе фаз, поэтому изменение количества вещества относят к площади раздела фаз:
 .
.
Скорость реакции зависит от следующих факторов: природа реагирующих веществ; концентрация реагирующих веществ; газовое давление; температура, катализатор.
9.2.Зависимость скорости реакции от концентрации реагирующих веществ подчиняется закону действия масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, каждая из которых взята в степени, равной соответствующему стехиометрическому коэффициенту в уравнении реакции (Гульдберг, Ваге).
Запишем химическую реакцию в общем виде: 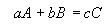 .
.
Если считать, что реакция протекает в гомогенной среде, то закон действия масс для неё выглядит следующим образом:
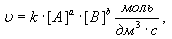 ,
,
где [А] и [В] – молярные концентрации веществ А и В;
а и в – показатели степеней, соответствующие количеству моль веществ А и В;
к – константа скорости реакции, зависящая от температуры, но не зависящая от концентрации реагирующих веществ. Уравнение для скорости реакции называется кинетическим уравнением химической реакции. Рассмотрим закон действия масс для конкретных реакций:
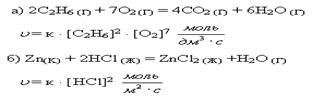 .
.
Цинк – твердое вещество, его участие в реакции учитывается константой скорости химической реакции.
9.3. Зависимость скорости гомогенной реакции от температуры. Влияние температуры на скорость химической реакции подчиняется правилу Вант-Гоффа: При изменении температуры на 10oС, скорость реакции изменяется в 2÷4 раза.
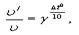 где ν - начальная скорость реакции;
где ν - начальная скорость реакции;
ν'-измененная скорость;
γ- температурный коэффициент;
Δt0- изменение температуры реакции. Зависимость константы скорости реакции от температуры также подчиняется уравнению Вант-Гоффа: 
Пример решения задачи При 20oС скорость реакции составляет 0,5. Чему равна скорость той же реакции при 70oС, если температурный коэффициент равен 2?
Решение:  .
.
9.3. Химическое равновесие характерно для обратимых реакций..Обратимыми называются реакции, в которых ни одно из исходных веществ до конца не расходуется. Обратимые реакции с определенного момента протекают в обоих направлениях – прямом и обратном:
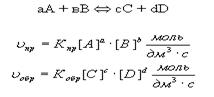 .
.
В обратимых реакциях устанавливается состояние равновесия, которое выражается в равенстве скоростей прямой и обратной реакций: 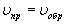 Состояние равновесия характеризуется константой равновесия (Кр):
Состояние равновесия характеризуется константой равновесия (Кр):
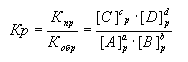 .
.
Индекс "р" означает равновесные концентрации веществ. Состояние равновесия устойчиво и может сохраняться как угодно долго, пока на систему не будет оказано какое-либо внешнее воздействие: изменение концентрации реагирующих веществ; изменение газового давления; изменение температуры. Нарушение состояния равновесия обратимой реакции означает, что скорости прямой и обратной реакций не равны друг другу. В зависимости от этого, равновесие обратимой реакции смещается либо в прямом  , либо в обратном
, либо в обратном  направлении. Направление смещения обратимой реакции подчиняется принципу Ле Шателье: "Если на систему, находящуюся в равновесии, оказать какое-либо внешнее воздействие, то равновесие сместится в таком направлении, чтобы ослабить оказанное воздействие".
направлении. Направление смещения обратимой реакции подчиняется принципу Ле Шателье: "Если на систему, находящуюся в равновесии, оказать какое-либо внешнее воздействие, то равновесие сместится в таком направлении, чтобы ослабить оказанное воздействие".
9.5. Фазовое равновесие. Правило фаз.
Равновесие перехода из одной фазы в другую без изменения химического состава называется фазовым равновесием. Примеры: переходы твердое вещество-жидкость-пар. Фазовое равновесие является динамическим равновесием,т.е. скорость прямого процесса равна скорости обратного процесса. Условием равновесия является ΔG=0.Для фазового равновесия соблюдается закон Ле-Шателье. К наиболее общим законам фазового равновесия относится правило фаз Гиббса.: Число степеней свободы С, фаз Ф, независимых компонентов К и внешних условий П, влияющих на равновесие, взаимосвязаны соотношением: С=К-Ф+ППод компонентами системы принято понимать химические вещества, которые могут существовать в изолированном виде и определять состав системы. Независимые компоненты – те, наименьшее число которых достаточно для образования всех фаз системы. Число степеней свободы – вариабельность системы; число независимых друг от друга факторов равновесия (число факторов, которые можно менять произвольно, не нарушая состояния системы) На фазовое равновесие обычно влияют температура и давление, П = 2, т.е. С=К-Ф+2.Для однокомпонентных систем правило фаз имеет вид:С=3-Ф=2, т.е .однофазная система имеет две степени свободы, двухфазная система имеет одну степень свободы, трехфазная система не имеет степеней свободы.
Дата добавления: 2015-08-08; просмотров: 846;
