Задания. 1.Какова процентная концентрация раствора, если в 200 г воды растворено 50 г вещества?
1.Какова процентная концентрация раствора, если в 200 г воды растворено 50 г вещества?
а) 25% б) 50% в) 20% г) 40%
2.Раствор, какого вещества замерзает при более низкой температуре?
i. а ) глицерина б) NaCI в) СН3СООН г) CaCI2
Ответы:
Лекция11. Свойства растворов электролитов. Степень диссоциации электролитов. Механизм диссоциации. Диссоциация слабых электролитов. Электролитическая диссоциация воды. Константа ионного произведения воды. Водородный показатель. Диссоциация сильных электролитов. Активность. Кажущаяся степень диссоциации. Условия необратимого протекания реакций между электролитами. Произведение растворимости. Гидролиз солей. Диссоциация комплексных соединений.
1.Степень диссоциации электролитов.Все электролиты диссоциируют на ионы, но в количественном отношении диссоциируют по - разному.
Количественной характеристикой диссоциации электролитов является степень диссоциации.Степень диссоциации: λ= n/N (доли ед.), где n - количество молекул данного электролита, которые продиссоциировали на ионы; N - общее количество молекул данного электролита в растворе.
Если степень диссоциации превышает 30%, электролит относится к сильным,если 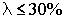 , то данный электролит является слабым.
, то данный электролит является слабым.
2. Механизм диссоциации И.А. Каблуков объяснил механизм диссоциации электролитов в воде на ионы. Электролиты диссоциируют на ионы в воде по двум механизмам:Ион - дипольный механизм; Диполь - дипольный механизм.
По ион - дипольному механизму диссоциируют на ионы те электролиты, которые имеют ионное строение. Когда электролит, имеющий ионную решетку, попадает в воду, то краевые ионы решетки начинают притягивать к себе молекулы воды и гидратируются ими. Под влиянием всевозможных видов движения гидратированные ионы отрываются от решетки и уходят в раствор. Процесс продолжается до полной диссоциации кристалла на ионы.Ион - дипольный механизм относится к диссоциации сильных электролитов.
Диполь- дипольный механизм:И электролит, и вода являются диполями. Два диполя притягиваются друг к другу, взаимно усиливая диполи. Оба полюса молекулы электролита оказываются гидратированными молекулами воды. Затем происходит полный разрыв молекулы электролита. В конечном итоге картина та же самая: гидратированные ионы уходят в раствор..
3.Диссоциация слабых электролитов. Суть диссоциации слабых электролитов в том, что они диссоциируют на ионы не полностью, обратимо.
Диссоциация слабых электролитов: 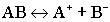 .Диссоциация слабых электролитов имеет две количественные характеристики:
.Диссоциация слабых электролитов имеет две количественные характеристики:
1) λ - степень диссоциации. Степень диссоциации не является константой, она зависит от двух факторов: от температуры (прямая зависимость); от концентрации раствора (обратная зависимость).
2) Константа диссоциации - это, по сути, константа равновесия обратимой реакции. Кр=КД=[A+]р*[B+]р/[AB]р. Константа диссоциации изменяется с температурой, причём зависимость прямая. От концентрации растворов константа диссоциации не зависит.
Взаимосвязь между степенью и константой диссоциации установил немецкий химик Оствальд. 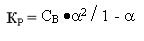 .Для слабых электролитов степень диссоциации много меньше единицы и поэтому в знаменателе формулы закона Оствальда ею пренебрегают.
.Для слабых электролитов степень диссоциации много меньше единицы и поэтому в знаменателе формулы закона Оствальда ею пренебрегают.
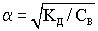 - закон разбавления Оствальда.
- закон разбавления Оствальда.
Многие слабые электролиты диссоциируют ступенчато. Каждая ступень имеет свою константу диссоциации 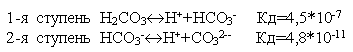 .
.
По первой ступени диссоциация заметна при нормальных условиях (при комнатной температуре). Диссоциация по второй ступени заметна при повышенной температуре, особенно при температуре кипения. Всегда Кд1>Кд2>Кд3
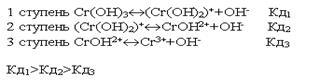
4.Ионное произведение воды. Водородный показатель Вода - самый слабый из существующих электролитов. Из 107 молекул воды диссоциирует на ионы только 1 молекула.  .Напишем выражение для константы диссоциации воды .Напишем выражение для константы диссоциации воды  ..Принимая равновесную концентрацию воды константой, получаем: ..Принимая равновесную концентрацию воды константой, получаем:
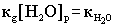 - ионное произведение воды (новая константа ). Отсюда получаем: - ионное произведение воды (новая константа ). Отсюда получаем:
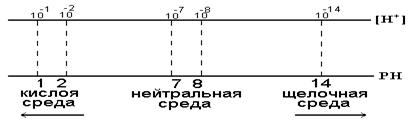
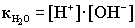 .При комнатной температуре .При комнатной температуре  . В воде, т.е. в нейтральной среде, концентрация ионов водорода равна концентрации ионов гидроксида и равна 10-7 моль/дм3. Физический смысл ионного произведения воды заключается в том, что оно справедливо не только для чистой воды, но и для растворов кислот, гидроксидов, солей. . В воде, т.е. в нейтральной среде, концентрация ионов водорода равна концентрации ионов гидроксида и равна 10-7 моль/дм3. Физический смысл ионного произведения воды заключается в том, что оно справедливо не только для чистой воды, но и для растворов кислот, гидроксидов, солей. 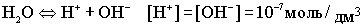 - нейтрльная среда
В H2O ввели кислоту, то есть Н+ [H+]>[OH- ] - нейтрльная среда
В H2O ввели кислоту, то есть Н+ [H+]>[OH- ] 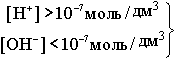 - кислая среда - кислая среда 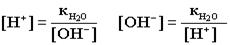 Если добавить к воде гидроксид, т.е. OH-, то [H+]<[OH- ].
Если добавить к воде гидроксид, т.е. OH-, то [H+]<[OH- ]. 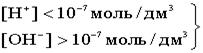 -щелочная среда. Чтобы избавится от отрицательной степени, для характеристики среды введено понятие водородныйпоказатель рH.рH = -lg[H+] -щелочная среда. Чтобы избавится от отрицательной степени, для характеристики среды введено понятие водородныйпоказатель рH.рH = -lg[H+]
Характер среды, то есть рH среды, определяют различными методами.Самое точное определение с помощью рH - метра. Наиболее простые методы измерения РН с помощью индикаторов. У жидких индикаторов есть свои интервалы измерения РН. Наиболее универсальным из индикаторов является лакмус. |
5.Диссоциация сильных электролитов. Диссоциация сильных электролитов настолько отличается от слабых, что была объяснена только через 40 лет после опубликования гипотезы Аррениуса. Суть диссоциации сильных электролитов заключается в том, что они диссоциируют полностью, необратимо:AB = A+ + B-.Истинная степень диссоциации сильных электролитов равна всегда 100 % (1,0 доли ед. ).В растворах сильных электролитов ионов очень много (особенно при повышенных концентрациях). Отсюда две особенности растворов сильных электролитов: расстояния между ионами очень малы, иногда всего в 2-3 раза больше, чем в кристаллической решетке; количество ионов электролита соизмеримо с количеством молекул воды, и поэтому не все ионы могут быть гидратированы молекулами воды. В силу этих двух особенностей каждый ион в растворе сильного электролита окружён ионами противоположного заряда, так называемой, "ионной атмосферой". В растворах сильных электролитов ионы мешают друг другу принимать участие в физических и химических процессах. Кажущаяся степень диссоциации (αкаж.) отражает то количество активных ионов, которые принимают участие в химических и физических процессах. Поэтому αкаж. всегда меньше 100 % (1,0). Истинная степень диссоциации сильных электролитов всегда равна 1,0, кажущаяся степень диссоциации возрастает с повышением температуры раствора и понижением концентрации раствора. Кажущаяся степень диссоциации связана с изотоническим коэффициентом соотношением: αкаж. = i-1 / n-1, где n - количество ионов, на которые диссоциирует данный электролит. Под активностьюпонимается та часть ионов, которая приняла участие в физических и химических процессах, активность всегда меньше концентрации. Поэтому αкаж< αист.Активность и концентрация связаны между собой коэффициентом активности γ: a = γ .c. Коэффициент активности - отношение экспериментальной величины к теоретической: γ = экспериментальная величина/теоретическая величина. В случае разбавленных растворов (для CB< 0,1М) коэффициент активности близок к единице, поэтому для разбавленных растворов сильных электролитов можно пользоваться понятием концентрации.
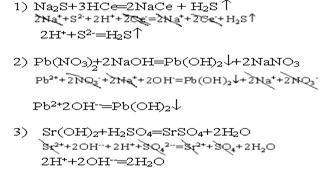
6.Условия необратимого протекания реакций между электролитами Все электролиты диссоциируют на ионы, поэтому суть реакции между электролитами выражают кратким ионным уравнением. Для того, чтобы реакция между электролитами протекала необратимо, необходимо, чтобы часть ионов оказалась связанной или в легко летучее соединение, или в трудно растворимый осадок, или в слабый электролит.
Дата добавления: 2015-08-08; просмотров: 1287;