Произведение растворимости
|
Любой раствор может быть насыщенным, ненасыщенным и перенасыщенным. Ненасыщенным называют раствор, в котором при данной температуре можно растворить ещё какое - то количество данного вещества.Насыщенным называют раствор, в котором скорость реакции растворения равна скорости реакции осаждения. Концентрация насыщенного раствора для данного вещества при данной температуре есть величина постоянная, следовательно в насыщенном растворе концентрации ионов данного электролита являются константами.Перенасыщенными называют растворы, которые содержат осадок. Насыщенные растворы трудно растворимых электролитов характеризуется величиной, называемойпроизведением растворимости.AB - трудно растворимый электролит:
AB=A++B-
ПРАВ = [A+]*[B-] - насыщенный раствор,
ПРАВ > [A+]*[B-] - ненасыщенный раствор,
ПРАВ < [Ag+]*[B-] - перенасыщенный раствор.
Be(OH)3  Bi3++3OH-
Bi3++3OH-
ПРBi(OH)3 = [Bi3+]*[OH--]3. Добавление в раствор одноимённых ионов труднорастворимого электролита способствует выпадению в осадок иона противоположного знака.
8. Гидролиз солей. Гидролизомназывается взаимодействие солей и воды, с образованием слабодиссоциирующих веществ, одновременно сопровождающееся смещением ионного равновесия воды. Отсюда следует, что не всякое взаимодействие соли с водой является гидролизом, а следовательно, не все соли гидролизу подвергаются. Гидролизу подвергаются соли, образованные катионом сильного основания и анионом слабой кислоты (Na2CO3,CH3COOK), катионом слабого основания и анионом сильной кислоты ( ZnCl2, Al2(SO4)3, катионом слабого основания и анионом слабой кислоты (CH3COONH4, Al2S3). Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются.При анализе состава солей нужно помнить, что:
| 1. К сильным основаниям относятся: LiOH, KOH, NaOH, CsOH, RbOH, Ca(OH)2, Ba (OH)2, Sr(OH)2, Rа(OH)2. 2.К сильным кислотам относятся: H2SO4, H2SеO4, HNO3, HClO4, HBr, HI, HCl. | 3. Слабые основания образуют катионы всех остальных металлов и NH4+. 4. К слабым кислотам относятся: H2SO3, HNO2, HClO, HF, H3PO3, H2CO3, H2S, H2SiO3 ,CH3COOH и др. |
Соли, образованные многокислотными основаниями, или многоосновными кислотами, подвергаются ступенчатому гидролизу. Более легко протекает первая ступень гидролиза, и на ней, как правило, при обычных условиях гидролиз солей завершается. Скорость гидролиза зависит от растворимости солей, оснований и кислот, поэтому необходимо учитывать этот фактор Гидролизу подвергается не все количество находящейся в растворе соли, а только часть ее. Иначе говоря, в растворе устанавливается равновесие между солью и образующими ее кислотой и основанием. Доля вещества, подвергающаяся гидролизу, - степень гидролиза, - зависит от константы этого равновесия, а также от температуры и концентрации соли.
Запишем уравнение гидролиза в общем виде. Пусть НА- кислота, МОН- основание, МА – образованная ими соль. Тогда уравнение гидролиза будет иметь вид:
МА + Н2О ↔НА + МОН
Этому равновесию отвечает константа:
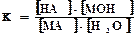
Концентрация воды в разбавленных растворах представляет собой практически постоянную величину. Обозначая К·[ Н2О] =Кг, получим:
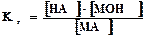 .Величина Кг называется константой гидролиза соли. Ее значение характеризует способность данной соли подвергаться гидролизу; чем больше Кг, тем в большей степени (при одинаковых температуре и концентрации соли) протекает гидролиз. Для соли, образованной катионом сильного основания и анионом слабой кислоты, константа гидролиза связана с константой диссоциации кислоты Ккисл зависимостью:
.Величина Кг называется константой гидролиза соли. Ее значение характеризует способность данной соли подвергаться гидролизу; чем больше Кг, тем в большей степени (при одинаковых температуре и концентрации соли) протекает гидролиз. Для соли, образованной катионом сильного основания и анионом слабой кислоты, константа гидролиза связана с константой диссоциации кислоты Ккисл зависимостью:


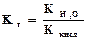 .Это уравнение показывает, что Кг тем больше, чем меньше Ккисл . Иными словами, чем слабее кислота, тем в большей степени подвергаются гидролизу ее соли. Для солей, образованных катионом слабого основания и анионом сильной кислоты, аналогичное выражение связывает константу гидролиза с константой диссоциации основания Косн
.Это уравнение показывает, что Кг тем больше, чем меньше Ккисл . Иными словами, чем слабее кислота, тем в большей степени подвергаются гидролизу ее соли. Для солей, образованных катионом слабого основания и анионом сильной кислоты, аналогичное выражение связывает константу гидролиза с константой диссоциации основания Косн
 .Поэтому, чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли. Степень гидролиза определяется природой соли, ее концентрацией и температурой. Природа соли проявляется в величине константы гидролиза. Зависимость степени гидролиза (h) от концентрации выражается через закон разбавления:
.Поэтому, чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли. Степень гидролиза определяется природой соли, ее концентрацией и температурой. Природа соли проявляется в величине константы гидролиза. Зависимость степени гидролиза (h) от концентрации выражается через закон разбавления:
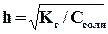 ,то есть с разбавлением раствора степень гидролиза увеличивается.
,то есть с разбавлением раствора степень гидролиза увеличивается.
Влияние температуры на степень гидролиза вытекает из принципа Ле-Шателье. Все реакции нейтрализации протекают с выделением теплоты, а гидролиз с поглощением теплоты. Поскольку выход эндотермических реакций с ростом температуры увеличивается, то и степень гидролиза растет с повышением температуры.
Пример 1.Составить молекулярное и ионное уравнение гидролиза соликарбоната натрия.
Решение. Соль Na2СO3 образована сильным основанием (NaOH) и слабой кислотой (H2СO3),таким образом,гидролиз соли будет протекать по аниону. Так как ион СO32- содержит 2 заряда, то гидролиз возможен в 2 ступени: первая ступень протекает в обычных условиях, вторая – при нагревании или разбавлении. Рассмотрим гидролиз по первой ступени:
Сокращенное ионное уравнение гидролиза:
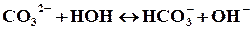
полное ионное уравнение гидролиза:
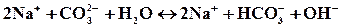
молекулярное уравнение:
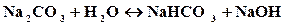
Так как в растворе накапливаются гидроксид-ионы, то среда щелочная, т.е. рН>7.
9. Диссоциация комплексных соединений.
В водных растворах комплексные соли диссоциируют в две стадии. Внешнесферная диссоциация комплексных солей происходит практически полностью с образованием комплекных ионов и ионов внешней сферы. Эта диссоциация называется первичной. Комплексные ионы, в свою очередь, под воздействием дополнительных внешних факторов, подвергаются вторичной диссоциации на центральный ион и лиганды. Вторичная диссоциация протекает незначительно и характеризуется константой равновесия, называемой константой нестойкости комплексного иона. Чем устойчивее комплексный ион, тем меньше его константа нестойкости.
Пример 2. Написать уравнения первичной и вторичной диссоциации комплексной соли [Ag(NH3)2]Cl. Составить выражение для константы нестойкости комплексного иона.
Решение. Первичная диссоциация протекает согласно уравнению:
[Ag(NH3)2]Cl→ [Ag(NH3)2]+ + Cl-
Комплексный ион, в свою очередь, подвергается вторичной диссоциации на центральный ион и лиганды:
[Ag(NH3)2]+↔ Ag+ +2 NH3; составим выражение для константы нестойкости комплексного иона:
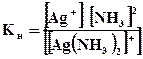
11.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
1. Ионные реакции в растворах..
2. Водородный показатель.
3. Гидролиз солей
4. Произведение растворимости.
5. Диссоциация комплексных соединений.
Дата добавления: 2015-08-08; просмотров: 1634;

