Фазовая диаграмма воды
Области между кривыми являются однофазными(С=2).Кривые соответствуют условиям равновесия между двумя фазами(С=1). В точке О существует равновесие между тремя фазами(С=0)- т.н тройная точка воды
 0А – равновесие (жидкость - пар)
0А – равновесие (жидкость - пар)
0В – Жидкость - лед
0С – пар-лед (испарение)
9.6.Упражнения для самоконтроля направлены на закрепление умения пользоваться следующими закономерностями:
1. Закон действующих масс
2. правило Вант-Гоффа..
3. Закон Ле-Шателье
Задачи
1. Как изменится скорость прямой гомогенной реакции 2А+2В=С+2D, если давление в системе увеличить в два раза?
2. Температурный коэффициент скорости некоторой реакции равен 2. Во сколько раз увеличится скорость этой реакции, если температуру повысить на 20 0С?
3. Составить выражение для константы равновесия реакции 2HBr(г)=H2(г)+Br2(г). Как необходимо изменить внешние факторы (температуру, давление, концентрацию исходного вещества), чтобы сместить равновесие реакции в сторону образования продуктов реакции? Тепловой эффект прямой реакции рассчитать в соответствии с законом Гесса.
Ответы
Лекция 10. Растворы. Свойства растворов
Понятие о растворах. Способы выражения количественного состава растворов. Закон эквивалентов для реакций в растворах. Основные законы растворов: законы Рауля и Вант – Гоффа. Особенности применения этих законов для растворов электролитов. Теория С. Аррениуса.
10.1. Понятие о растворах. Способы выражения количественного состава растворов Раствором называется твердая или жидкая гомогенная (однородная) система, состоящая из двух или более компонентов. Необходимыми компонентами раствора являются растворитель и растворенное вещество, например, растворенный в воде сахар. В одном растворителе может находиться несколько растворенных веществ. Например, в воде растворены сахар, соль и уксусная кислота. Количество растворенного вещества в определенном количестве раствора или растворителя, которое может колебаться в очень широких пределах, называется концентрацией раствора. Существует несколько способов выражения концентрации растворов.
 Х – концентрация
Х – концентрация 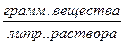 Y – концентрация
Y – концентрация 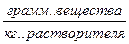
g – процентная концентрация 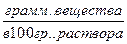
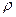 - плотность
- плотность 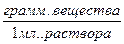
1мл.=1см3
С, СМ, М – молярность 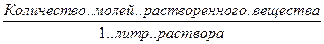
Сэ, Н – нормальность 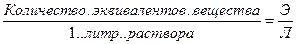
Сm ,m – моляльность 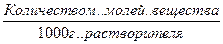
Т – титр 
N – мольная доля 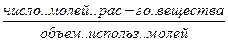
Виды растворов:
- Разбавленные (малой концентрации)
- Концентрированные (большой концентрации)
- Насыщенные (предельно допустимая концентрация)
Пересыщенные (концентрация больше предельно допустимой, такие растворы неравновесные)
Пример 1.Какую массу воды нужно прибавить к 200мл 15% раствора Н2SO4 (r=1,11 г/мл), чтобы получить 10%-ный раствор? Какова нормальность исходного раствора?
Решение.масса 200мл 15%-ного раствора Н2SO4 равна 200×1,11=222г. В этом растворе содержится 15% Н2SO4 т.е. 222×0,15=33,3г.
1. По условию задачи эта масса составит 10% от общей массы
разбавленного раствора. Тогда масса полученного раствора будет равна
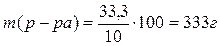 .
.
2. Следовательно, к исходному раствору необходимо добавить воды
mH2O = mр2-ра - m1 р-ра = 333-222=111г.
3. По определению, нормальность раствора равна количеству эквивалентов Н2SО4 в 1л раствора:
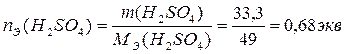 ,
,
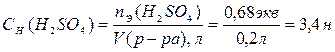 .
.
Таким образом, нормальность исходного раствора равна 3,4 экв/л.
Ответ: m(Н2О)=111 г; СН=3,4 н.
Закон эквивалентов для растворов. Если два раствора взаимодействуют между собой в эквивалентных количествах, то зная концентрацию одного из растворов и прореагировавшие объемы обоих растворов, можно рассчитать неизвестную концентрацию второго раствора по соотношению: 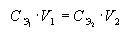 .
.
2. Основные законы растворов: законы Рауля и Вант – Гоффа. Эти законы являются коллигативными, то – есть зависят не только от концентрации растворов, но и от количества частиц в них.
I закон Рауля Относительное понижение давления паров растворителя над раствором (D р) равно мольной доле растворенного вещества.
D p= p0-p1= p0 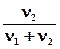 , (6.1)
, (6.1)
где р1 – парциальное давление насыщенного пара растворителя над раствором; р0 – давление насыщенного пара над чистым растворителем;
n1 – количество растворителя; n2 – количество растворенного вещества.
II закон Рауля При растворении вещества расширяется температурный интервал существования жидкой фазы растворителя вследствие смещения его температуры кристаллизации (замерзания) в низкотемпературную область, а температуры кипения – в высокотемпературную):
D Тф.п. = К× Сm , (6.2)
где D Тф.п. –изменение температуры фазового перехода (кристаллизации или кипения), К – коэффициент пропорциональности, зависящий от свойств растворителя; для кристаллизации – криоскопическая константа (Кк), для кипения – эбуллиоскопическая константа (Кэ). Для наболее распространенного растворителя-воды эти константы равны: Кк = 1,86К/моль, Кэ = 0,52К/моль.
Ст– моляльная концентрация растворенного вещества.
3. Закон Вант-Гоффа:
Закон Вант – Гоффа определяет величину осмотического давления раствора. Чтобы ознакомиться с понятием осмоса, рассмотрим сосуд, разделённый на две части полупроницаемой мембраной. Полупроницаемая мембрана – перегородка, через которую проникают молекулы растворителя, но не проходят частицы растворённого вещества.
Осмос представляет собой самопроизвольное одностороннее перемещение молекул растворителя через полупроницаемую мембрану из той части системы, где концентрация растворителя выше, в ту часть системы, где его концентрация ниже.
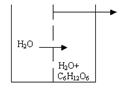 Определение осмотического давления растворов производится следующим образом. Во внешний сосуд наливается чистая вода, стенки внутреннего сосуда представляют собой полупроницаемую мембрану. Внутренний сосуд снабжен оттянутой горловиной и мерительной линейкой. Во внутреннем сосуде находится какой - либо раствор, например, сахара. В силу осмоса молекулы воды из внешнего сосуда через полупроницаемые стенки будут проходить во внутренний, движение молекул в этом приборе только одностороннее. Таким образом, объём раствора во внутреннем сосуде увеличивается и поднимается по оттянутой горловине. В результате разницы в уровнях жидкостей во внешнем и внутреннем сосудах в приборе возникает гидростатическое давление. Это давление препятствует осмосу. Величина гидростатического давления, при которой осмос прекращается, называется осмотическим давлением раствора. (Росмотическое, кПа ) Определение осмотического давления растворов производится следующим образом. Во внешний сосуд наливается чистая вода, стенки внутреннего сосуда представляют собой полупроницаемую мембрану. Внутренний сосуд снабжен оттянутой горловиной и мерительной линейкой. Во внутреннем сосуде находится какой - либо раствор, например, сахара. В силу осмоса молекулы воды из внешнего сосуда через полупроницаемые стенки будут проходить во внутренний, движение молекул в этом приборе только одностороннее. Таким образом, объём раствора во внутреннем сосуде увеличивается и поднимается по оттянутой горловине. В результате разницы в уровнях жидкостей во внешнем и внутреннем сосудах в приборе возникает гидростатическое давление. Это давление препятствует осмосу. Величина гидростатического давления, при которой осмос прекращается, называется осмотическим давлением раствора. (Росмотическое, кПа )
|
При постоянной температуре осмотическое давление раствора Р пропорционально его молярной концентрации
Р=1000СМ RT, Па
где СМ – молярная концентрация, R- газовая постоянная (8,314 Дж/моль×К),Т – температура, К
Пример 2.При какой температуре замерзает водный раствор, полученный из 250г воды и 54 г глюкозы С6Н12О6 ?
Решение.При пересчете на 1000г воды, содержание глюкозы в растворе равно 216 г. Так как мольная масса глюкозы составляет 180 г/моль, то моляльность раствора равна Сm=216/180=1,20 моль/кг (Н2О) .
По формуле (6.2) находим:
D tкрист =К× Сm =1,86×1,20=2,23°С.
Т.к. чистая вода кристаллизуется при 0°С, то раствор будет кристаллизоваться при tкр р-ра= t кр.р-ля- D t крист=00С-2,23=-2,230С
Ответ:tкрист = - 2,23°С.
3.Особенности применения законов Рауля и Вант-Гоффа для растворов электролитов.Теория С. Аррениуса. Электролиты – вещества, которые в воде диссоциируют на ионы.
Существует три класса электролитов: кислоты, гидроксиды, соли. Растворы электролитов имеют две особенности по сравнению с растворами неэлектролитов: проводят электроток, подчиняются законам Рауля и Вант - Гоффа с определёнными отклонениями. Обе особенности растворов электролитов объяснила гипотеза шведского учёного Сванте Аррениуса (1883 г). Гипотеза Аррениуса сводилась к тому, что вещества неидеальных растворов, то - есть то, что сейчас называется растворами электролитов, в воде диссоциируют на ионы. Поскольку неидеальные растворы проводили электроток, то их называли растворами электролитов. Для растворов электролитов в математические выражения законов Рауля и Вант - Гоффа был введён поправочный коэффициент. Ввёл его Вант – Гофф и назвал его изотоническим коэффициентом. i - поправочный коэффициент (изотонический коэффициент).
| Раствор неэлектролита | Раствор электролита | |
| CB = 1 моль / л | CB = 1 моль / л | |
| С12H22O11 | NaСl= Na++Cl- | |
| Сахар в воде диссоциирует | Соль в воде диссоциирует | |
| на молекулы | на ионы | |
| 1 моль молекул | 1 моль Na+ 1 моль Cl- | |
| Частиц будет больше | ||
| в 2 раза | ||
| Al(NO3)3=Al3++3NO-3 | ||
| Al(NO3) = Al3+ + 3NO-3 | ||
| (в 4 раза больше) | ||
| 1) 1< i <2 | ||
| 2) 1< i <4 |
Законы Рауля для растворов электролитов:
ΔP / РА = i NB,
D Тф.п. =iК× Сm
Закон Вант – Гоффа для растворов электролитов:
Росмотическое = i RTCB
Физический смысл изотонического коэффициента состоит в том, что он учитывает увеличение количества частиц в растворе электролита по сравнению с раствором неэлектролита той же концентрации.
пример найти изотонический коэффициент для раствора электролита с концентрацией растворенного вещества 0,2М, если известно, что в 1 дм3 этого раствора содержится 2,18·1023 частиц (молекул и ионов) растворенного вещества.
Решение: i=Nфакт/Nрасч., где Nфакт- количество частиц(молекул и ионов) растворенного вещества, присутствующих в растворе; Nрасч - количество молекул растворенного вещества. i=Nфакт/ NА·СМ =2,18·1023/(6,02·1023·0,2) = ,
10.6.Упражнения для самоконтроля направлены на закрепление знаний в области:
1. концентрации растворов
2. криоскопии и эбулиоскопии..
3. изотонического коэффициента.
Дата добавления: 2015-08-08; просмотров: 1172;
