Лекция 7. Термохимия
Предмет и основные понятия химической термодинамики. Изолированные, закрытые и открытые ситемы. Понятие фазы, гомогенной и гетерогенной систем. Термодинамические параметры системы. внутренняя энергия, энтальпия, энтропия и термодинамические потенциалы как функции состояния. Изотермические, изохорные и изобарные процессы. Первый закон термодинамики как частный случай закона сохранения энергии. Различные формулировки закона. Его математическое выражение. Применение закона к изотермическому, изохорному и изобарному процессам. термохимия. Стандартные условия для оценки теплового эффекта реакций. Изменение энтальпии в экзотермических и эндотермических реакциях. Закон Гесса и его следствия.
Предмет и основные понятия химической термодинамики.



- внутренняя энергия U–полная энергия частиц, составляющих данное вещество; она слагается из кинетической энергии поступательного, колебательного и вращательного движения частиц, а также потенциальной энергии сил притяжения и отталкивания, действующих между частицами.
- энтальпия системы Н –термодинамическая функция, характеризующая систему, находящуюся при постоянном давлении; Н=U+pV, где p и V – соответственно, давление и объем системы;
- энтропия S и ее изменение DS, являющиеся мерой структурной неупорядоченности системы, Дж/(моль×К);
- свободная энергия Гельмгольца (F) и ее изменение D F, которые являются мерой химического сродства и критерием самопроизвольного протекания изохорно-изотермических процессов, кДж/моль;
- свободная энергия Гиббса G и ее изменение DG, которые являются мерой химического сродства и критерием самопроизвольного протекания изобарно-изотермических процессов, кДж/моль.

2.Первый закон термодинамики Основным законом термодинамики и одним из важнейших законов природы является первое начало термодинамики. Этот закон был установлен в результате работ Майера (1842г) и Джоуля (1843г). Первым началом термодинамики этот закон назвал Р. Клаузиус .Первое начало термодинамики в замкнутой системе энергия не возникает и не исчезает, при переходе одних форм энергии в другие сумма их остаётся неизменной. Согласно первому началу термодинамики, количество энергии, которое поглощается или выделяется в форме теплоты Q и работы A, постоянно для данного процесса, т.к. энергия не может исчезать или возникать, и следовательно, количество подведённой теплотыи совершённой работы равно изменению внутренней энергии: Q + A = ΔU. Работа, как правило, совершается против внешних сил A = -P (V2- V1)= -PΔV. Подвод теплоты к системе может осуществляться при двух процессах: изохорном и изобарном.
Изохорный процесс:
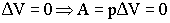
Вывод: при изохорном процессе подведённая теплота полностью расходуется на изменение внутренней энергии системы: QV = ΔU.
Изобарный процесс:
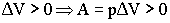
ΔU= Qp + A = Q- pΔ V ;
Qp= ΔU – A = ΔU + pΔ V
Qp= U2-U1 + p(V2 – V1) = ( U2 + pV2 ) – (U1 + pV1).
Функция U + pV = H – называется энтальпией.
Итак, U2 + pV2 и U1 + pV1 – величины энтальпий для состояний 2 и 1 системы, соответственно:
U2 + pV2 = H2;
U1 + pV1 = H1.
Тогда Qp = H2 – H1 = ΔH.
Теплота, подведённая к системе при постоянном давлении, равняется изменению энтальпии данной системы. Изменение энтальпии – теплота, выделившаяся при изобарном процессе. Поскольку энтальпия выводится из внутренней энергии, она также является функцией состояния. Измеряется и рассчитывается не сама энтальпия, а её изменение, приведённое к нормальным условиям: ΔH 0298 кДж/моль. Образование веществ может происходить как с поглощением, так и с выделением энергии. Если величина Qp положительна, то реакция эндотермическая, т.е. энтальпия продуктов реакции выше энтальпии исходных веществ. Если величина Qp отрицательна, то реакция экзотермическая: энтальпия продуктов реакции ниже энтальпии исходных веществ. Вещество тем прочнее, чем больше энергии выделяется при его образовании.
3.Закон Гесса. Изменение энтальпии химической реакции, то - есть и тепловой эффект, подчиняется закону Гесса (1840г).Тепловой эффект химической реакции зависит только от начального и конечного состояния химической реакции, то - есть зависит от вида и состояния исходных веществ и продуктов реакции.
Следствие закона Гесса: Изменение энтальпии химической реакции равно сумме изменений энтальпий продуктов реакции за вычетом суммы изменения энтальпий исходных веществ.
aA + bB = cC + dD
ΔH 0х.р. = (cΔH 0C + dΔH 0D ) – (aΔH 0A + bΔH 0B ) кДж.
Тепловой эффект реакции образования одного моля вещества из простых веществ называется теплотой образования DН данного вещества. Энтальпию образования 1 моль сложного вещества из простых веществ, измеренную при температуре 298К и давлении 101,325 кПа, называют стандартной энтальпией образования 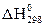 , кДж/моль. Энтальпии простых веществ (О2, Н2, S и т.п.) условно принимают равными нулю.
, кДж/моль. Энтальпии простых веществ (О2, Н2, S и т.п.) условно принимают равными нулю.
Термохимические расчеты осуществляют, применяя следствие из закона Гесса:
Пример1. Вычислить тепловой эффект, написать термохимическое уравнение горения 1 моль метана и рассчитать количество теплоты, которое выделится при сгорании 10 л CH4.
Решение.Составим термохимическое уравнение реакции
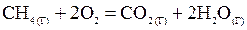 .
.
Выпишем стандартные теплоты образования 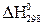 веществ (табл. 2 прил.2):
веществ (табл. 2 прил.2):
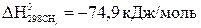 ;
;
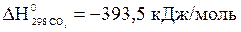 ;
;
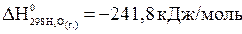 .
.
Тепловой эффект реакции вычислим, используя следствие закона Гесса:
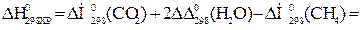
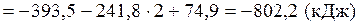
При сжигании 22,4 л выделяется 802,2 кДж, при сжигании 10л выделяется х кДж. Составим и решим пропорцию:
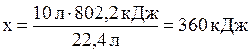 .
.
Ответ: 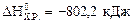 , при сжигании 10 л метана выделяется 360 кДж.
, при сжигании 10 л метана выделяется 360 кДж.
7.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
1. Определениемолярной теплоты образования соединения.
2. Определениетеплового эффекта реакции.
Дата добавления: 2015-08-08; просмотров: 2539;
