Nbsp; Лекция 6. Основы химической кинетики
Раздел химии, в котором изучаются скорости и механизмы химических реакций, называется химической кинетикой. Рассмотрим основные понятия химической кинетики.
Система – материальный объект (тело или группа тел), занимающий часть пространства и выделенный из окружающего мира реально существующими или воображаемыми поверхностями (границами) раздела.
Различают гомогенную и гетерогенная системы:
1. Гомогенная– система, которая одинакова и однородна во всех точках и представляет собой одну фазу, (пример: раствор соли).Фаза – это совокупность однородных материальных частей системы, отделенных от других частей поверхностями раздела.
2. Гетерогенная– система, состоящая из нескольких фаз (пример: вода со льдом).
Химические реакции, протекающие в гомогенных системах, называются, гомогенными, а реакции, протекающие в гетерогенных системах – гетерогенными.
Скорость гомогенной химической реакции – это количество вещества (Δn), вступившего в реакцию или образовавшегося в результате химической реакции за единицу времени (t) в единице объема системы (V):
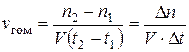 ,
,
где n1 – число молей реагирующего вещества в момент времени t1; n2 – число молей реагирующего вещества в момент времени t2; V – объем реакционного сосуда.
При постоянном объеме реакционного сосуда 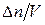 – изменение молярной концентрация вещества (ΔС). Таким образом, скорость гомогенных химических реакций можно выразить следующим уравнением:
– изменение молярной концентрация вещества (ΔС). Таким образом, скорость гомогенных химических реакций можно выразить следующим уравнением: 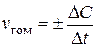 .
.
Следовательно, скорость гомогенной реакции равна изменению концентрации какого-либо из реагирующих веществ в единицу времени и выражается в моль/(л×с). Знак «+» ставится в том случае, если ΔС – концентрация продукта реакции. Знак «–» – если ΔС – концентрация исходного вещества.
Скоростью гетерогенной реакции называется количество вещества, которое вступает в реакцию или образуется в результате реакции в единицу времени на единице поверхности раздела фаз S:
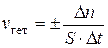 .
.
Скорость любой химической реакции зависит от следующих факторов:
1) природы реагирующих веществ;
2) концентрации реагирующих веществ;
3) температуры;
4) присутствия катализаторов.
Скорость гетерогенных реакций зависит также от: величины поверхности раздела фаз, скорости подвода реагирующих веществ к поверхности раздела фаз и скорости отвода от нее продуктов реакции.
Зависимость скорости химической реакции от концентрации реагирующих веществ выражается законом действующих масс (Гульдберг и Вааге, Норвегия, 1867 г.). Скорость химической реакции пропорциональна концентрациям реагирующих веществ.
Так, например, для реакции
aA + bB ® cC + dD
скорость реакции определяется уравнением ν = k САа СBb (закон действующих масс), где СА и СB – концентрации исходных веществ; k – константа скорости химической реакции, которая равна скорости химической реакции при концентрациях реагирующих веществ, равных 1 моль/л.
Константа скорости не зависит от концентрации, а зависит только от температуры, наличия катализатора и природы реагирующих веществ.
Зависимость скорости химической реакции от температуры выражается правилом Вант-Гоффа. При повышении температуры на каждые 10° скорость большинства реакций в определенной области температур возрастает в 2–4 раза:
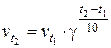 ,
,
где g – температурный коэффициент химической реакции, который показывает, во сколько раз увеличивается скорость химической реакции при повышении температуры на 10°; vt1 и vt2 – скорости химических реакции при температурах t1 и t2, соответственно.
Из последнего уравнения видно, что небольшое увеличение температуры вызывает резкое повышение скорости химической реакции. Этот факт объясняет теория активных молекул (теория активных соударений). Согласно этой теории, для того чтобы произошла химическая реакция, реагирующие молекулы должны столкнуться (т.е. скорость зависит от общего числа столкновений). Однако не все столкновения приведут к химической реакции. Во-первых, сталкивающиеся молекулы должны соударяться определенным местом, т.е. удар должен производиться в реакционную часть молекулы. Для этого молекулы должны быть определенным образом в момент соударения ориентированы (стерический фактор).
Во-вторых, наличие сил отталкивания между молекулами приводит к тому, что в химической реакции могут участвовать только те молекулы, энергия которых больше средней энергии молекул на какую-то определенную величину. Эта избыточная энергия называемая энергией активации(E, Дж/моль), онапозволяет преодолеть энергию отталкивания между молекулами. Молекулы, избыточная энергия которых больше, чем значение энергии активации, называются активными молекулами. Чем больше число активных молекул, тем больше скорость химической реакции. При повышении температуры число активных молекул (N) резко возрастает и определяется уравнением Максвелла-Больцмана: N = NA exp(–E / RT), где NA – постоянная Авогадро.
Зависимость скорости химической реакции (или ее константы k) от температуры (Т) выражается уравнением Аррениуса:
lnk = lnA – E / RT, или k = A e(–E / RT),
где А – постоянная для данной реакции величина и зависящая от общего числа столкновений и стерического фактора.
Одним из важнейших факторов, влияющих на скорость химических реакций, является присутствие катализатора. Катализатор – это вещество, которое, участвуя в химической реакции, изменяет скорость химической реакции, но само при этом не расходуется. Явление изменения скорости химической реакции при участии катализатора – катализ. Реакции, протекающие с участием катализаторов – каталитические. Катализ бывает гомо- и гетерогенным. Если реагенты и катализатор находятся в одном агрегатном состоянии, то такой катализ называется гомогенным. В случае гетерогенного катализа реагенты и катализатор находятся в разном агрегатном состоянии. Катализатор может ускорить только ту реакцию, для которой изобарно-изотермический потенциал меньше нуля (ΔG < 0), т.е. реакция может протекать самопроизвольно. Механизм действия катализатора очень сложен и сводится к образованию промежуточных нестабильных соединений, образование которых осуществляется с меньшим значением энергии активации.
Вещества, которые уменьшают скорость реакции, называются ингибиторами.
Катализ играет огромную роль не только в химии, но и в биологии. Практически все биохимические процессы протекают с участием биологических катализаторов – ферментов, которые по своей природе являются белками.
Как правило, химические реакции являются сложными и состоят из двух или нескольких простых реакций. Химические реакции могут быть разделены на необратимые (идут до конца) и обратимые (до конца не протекают), а также параллельные (реакции, в которых из одного вещества получается два или больше). Последовательные реакции – это реакции, в которых продукты превращения исходного вещества являются исходным веществом для получения третьего и т.д. Реакция, которая протекает наиболее медленно, называется лимитирующей.
Цепныереакции – это реакции, в которых в каждом элементарном акте возникает одна или несколько активных частиц, что вызывает цепь превращений.
Наиболее интересными являются сопряженные реакции (реакции, в которых одна реакция протекает только при осуществлении какой-либо определенной другой реакции, при этом происходит перераспределение энергии от одной реакции (ΔG < 0) к другой (ΔG > 0)) и колебательные,илипериодические (данные реакции характеризуются колебаниями концентраций некоторых промежуточных соединений и, соответственно, скорости превращения).
Дата добавления: 2015-08-26; просмотров: 3793;
