Энергия Гиббса химической реакции
Объединив уравнения ΔQ = ΔU + pΔV + ΔA* и ΔS = ΔQ / T, и учитывая, что ΔH = ΔU + pΔV получим
Т ΔS = ΔH + ΔА* или ΔА* = – (ΔH – Т ΔS).
В термодинамике величину ΔH – Т ΔS = ΔG определяют как изменение энергии Гиббса.Энергия Гиббса (H – Т S = G) есть термодинамическая функция состояния системы, а ее изменение при химических взаимодействиях DG – энергиея Гиббса химической реакции.
Поскольку работа есть величина положительная, то система совершает работу над окружающей средой только в том случае, если энергия Гиббса будет меньше нуля (ΔG < 0). Таким образом, в закрытой системе самопроизвольно совершаются только те процессы, которые идут с уменьшением энергии Гиббса. Пределом этой убыли является минимальное значение G, отвечающее состоянию равновесия системы.
Если ΔG > 0, то процесс самопроизвольно протекать не может. В случае если ΔG = 0, т.е. ΔH = Т ΔS, то имеет место такое состояние, при котором реакция не идет ни в прямую, ни обратную сторону. Это состояние называется равновесным.
Из сказанного следует, что DG является критерием направления и предела самопроизвольного протекания изобарно-изотермического процесса. Из уравнения ΔG = ΔH – Т ΔS следует, что протекание самопроизвольной химической реакции зависит от двух факторов:
1) ΔH – стремление системы обладать минимальным запасом внутренней энергии;
2) Т ΔS – стремление системы принимать состояние с наиболее возможным беспорядком.
Энергия Гиббса образования химических соединений.Энергия Гиббса химической реакции DG, являясь изменением термодинамической функции состояния системы G, может быть вычислена по разности
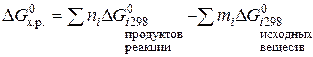 .
.
Стандартной энергией Гиббса образования химического соединения DG°обр называют энергию Гиббса реакции образования одного моля этого соединения, находящегося в стандартном состоянии, из соответствующих простых веществ, также находящихся в стандартных состояниях и термодинамически устойчивых при данной температуре фазах и модификациях.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми. Необратимых реакций не так много. Большинство реакций являются обратимыми. Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
Таким образом, химическая термодинамика отвечает на вопросы:
− о возможности протекания реакции самопроизвольно в нужном направлении;
− сколько при этом выделится энергии;
− когда процесс закончится, т.е. наступит равновесие;
− если процесс самопроизвольно протекать не может, то сколько необходимо подвести энергии или какие необходимо создать условия (температура, давление, концентрация и другие факторы) для его протекания.
Химическая (равновесная) термодинамика не отвечает на вопрос о скорости процесса.
Дата добавления: 2015-08-26; просмотров: 2108;
