Таким образом тепловой эффект химической реакции равен ΔН, которая в термодинамике носит название энтальпия.
Из первого закона термодинамики следует, что тепловой эффект химической реакции(при р = const и Т = const)не зависит от пути ее протекания, а зависит лишь от природы и физического состояния исходных веществ и продуктов реакции (закон Г. И. Гесса).
Термохимические расчеты. В основе большинства термохимических расчетов лежит следствие из закона Гесса: тепловой эффект химической реакции равен сумме теплот (энтальпий) образования продуктов реакции(ΔН)за вычетом суммы теплот (энтальпий) образования исходных веществ с учетом стехиометрических коэффициентов(n, m)в уравнении реакции:
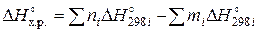 (1)
(1)
продукты исходных
реакции веществ
Энтальпия образования химических соединений (DН) – изменение энтальпии в процессе получения этого соединения из простых веществ, устойчивых при данной температуре.
Стандартной энтальпией (теплотой) образования химического соединения (ΔН°298) называется изменение энтальпии в процессе образования одного моля этого соединения, находящегося в стандартном состоянии
(Т = 298 К и давление р = 1,01∙10–5 Па), из простых веществ, также находящихся в стандартных состояниях и термодинамически устойчивых фазах и модификациях. Стандартные энтальпии образования простых веществ принимают равными нулю, если их агрегатные состояния и модификации устойчивы при стандартных условиях. Стандартная энтальпия образования соединения – мера его термодинамической устойчивости, прочности.
Если DН > 0, реакцию называют эндотермической, если же теплота выделяется в окружающую среду DН < 0, реакцию называют экзотермической.
Поскольку значение DН определяется по уравнению (1) и не зависит от пути и способа проведения процесса, энтальпию относят к термодинамическим функциям состояния системы.
Первый закон (или начало) термодинамики ничего не говорит о направлении процесса, т.е. о направлении химической реакции. На этот вопрос отвечает второе начало термодинамики. Второй закон термодинамики выполняется только для систем, состоящих из большого количества молекул, для которых применимо понятие – вероятность состояния системы.
Число микросостояний системы, которые могут обеспечить данное макросостояние системы, называют термодинамической вероятностью(W). Больцман установил связь между термодинамической вероятностью и энтропией системы (S):
S = k lnW,
где k – постоянная Больцмана, k = R / NA.
Изменение энтропии, как правило, определяется по уравнению
ΔS = ΔQ / T.
Энтропия является мерой неупорядоченности состояния системы. При переходе системы из менее упорядоченного состояния (с большим беспорядком) в более упорядоченное (с меньшим беспорядком) энтропия убывает. При переходе из газообразного в жидкое, а затем в кристаллическое (твердое) состояние степень беспорядка убывает, при этом убывает и энтропия системы. Энтропия – термодинамическая функция состояния системы (Дж/(моль×К)). Изменение энтропии (DS) при химических реакциях определяется следующим образом:
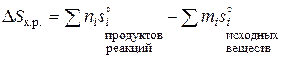 .
.
На основании понятия энтропии, второй закон термодинамики формулируется следующим образом: в изолированной системе самопроизвольно, т.е. без подвода энергии извне, совершаются только те процессы, которые обеспечивают повышение энтропии системы.
Третий закон термодинамики касается абсолютного значения энтропии. В настоящее время определить экспериментально или рассчитать абсолютное значение внутренней энергии и энтальпии не представляется возможным. Однако абсолютное значение энтропии определить возможно. Если принять, что при температуре абсолютного нуля все вещества находятся в кристаллическом состоянии, и при этом отсутствует всякое движение атомов и (или) молекул, за исключением движения электронов, то термодинамическая вероятность такого состояния будет равна единице (W = 1). Таким образом, используя уравнение Больцмана для расчета энтропии, получи, что при данной температуре S = 0. Это и есть третий закон термодинамики.
Дата добавления: 2015-08-26; просмотров: 1527;
