Межмолекулярное взаимодействие
Лишь немногие элементы (благородные газы) находятся в обычных условиях в состоянии одноатомного газа. Атомы остальных – входят в состав молекул или кристаллических решеток. Причина – «химическая связь».
Химическая связь – это силы, которые удерживают атомы в молекуле. При образовании химической связи энергия молекулы меньше энергии атомов, из которых состоит молекула. Избыточная энергия выделяется в виде теплоты. Природа химической связи едина – это взаимодействие между заряженными частицами (ядрами и электронами). В зависимости от способа реализации различают следующие типы связи: ковалентная, ионная, металлическая, водородная.
Теория химического строения.Химическая связь образуется за счет обобществления пары электронов с разным спином (современная теория ковалентной связи).
При взаимодействии двух атомов один атом отдает, другой принимает электрон – основа современной теории ионной связи.
Правило октета: в результате образования химической связи атомы могут приобретать такую же электронную конфигурацию, как у благородных газов, которые имеют на внешнем слое 8 электронов.
Количественные характеристики химической связи.Чем больше энергия связи, тем устойчивее молекула. Энергия связи (Есвязи) – мера прочности связи.
Длина связи – расстояние между ядрами в соединении, зависит от размеров электронных оболочек и степени их перекрытия.
Химическая связь характеризуется углом между линиями, соединяющими ядра атомов.
Ионная связь.Электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении возникает в случае большой разницы в электроотрицательности (ЭО) атомов. Так как действие электрического поля вокруг заряженной частицы имеет сферический характер, то для ионной связи не характерно направленность и насыщенность.
Вещества с ионной связью в обычных условиях являются твердыми, с большой температурой плавления и кипения. Их растворы и расплавы проводят электрический ток.
Так как энергия ионизации больше энергии сродства к электрону, то не происходит полного перехода электрона от одного атома к другому, следовательно, нет чисто ионной связи. Можно говорить только о большей или меньшей степени ионности. Предполагается, что ионная связь образуется при ΔЭО > 1,7.
Ковалентная связь.Химическая связь, образованная путем обобществления пары электронов двумя атомами, называется ковалентной. При оптимальном расстоянии между ядрами система имеет минимальную энергию – Есвязи.
Особенности ковалентной связи: направленность и насыщаемость. Направленность обусловлена пространственной ориентацией атомных орбиталей. Ковалентная связь направлена в сторону максимального перекрывания АО. Количественно направленность характеризуется валентным углом между линиями, соединяющими ядра атомов. Насыщаемость вызвана ограниченным количеством электронов на внешней оболочке, которые могут участвовать в образовании связи. Полярность: если обобществленные атомы распределены равномерно между атомами – неполярная связь (Н–Н, О=О). Полярная: один из атомов сильнее притягивает электроны, и электронная плотность смещается в его сторону; критерием способности притягивать электрон является ЭО. Таким образом, разность ЭО характеризует полярность связи (ковалентно-полярная ∆ЭО > 0,7).
Существует два приближенных метод расчета распределения электронной плотности в молекуле: метод валентных связей (ВС) и метод молекулярных орбиталей (МО).
Метод валентных связей (1927 г. Тейтлер и Лондон) предполагает:
1) атомы в молекуле сохраняют свою индивидуальность;
2) электронная пара «заселяет» орбиталь то одного, то другого атома;
3) химическая связь между атомами возникает как результат перекрывания АО;
4) атомы, вступающие в связь, обмениваются электронами, которые образуют связывающие пары;
5) в соответствии с принципом Паули, химическая связь образуется при взаимодействии электронов с антипараллельными спинами;
6) характер химической связи определяется типом перекрывания АО.
Обменный механизм образования химической связи метода ВС.Валентность – способность атома присоединять или замещать определенное число других атомов с образованием химической связи. Количественная мера в обменном механизме ВС – число неспаренных электронов в основном или возбужденном состоянии. Каждый атом предоставляет по одному электрону в общее пользование.
Донорно-акцепторный механизм.Обменный механизм не может объяснить образование некоторых химических соединений. Общая пара образовалась за счет пары электронов одного атома (донора) и свободной орбитали другого (акцептора).
Таким образом, суммарная валентность равна сумме числу неспаренных электронов и числа связей способных образовываться по донорно-акцеп-торному механизму.
Метод МО.Электроны в молекуле распределены на МО, которые имеют определенную энергию и форму. МО охватывает всю молекулу в целом. Атомы не сохраняют индивидуальность. Молекулы – единая система.
В методе МО используется линейная комбинация атомных орбиталей (ЛКАО), при этом соблюдается ряд правил:
1. Число МО равно числу АО, из которых они комбинируются.
2. Энергия одних МО выше, других – ниже исходных АО.
3. Электроны заполняют МО в порядке возрастания энергии, при этом соблюдаются правило Паули и правило Гунда.
4. Наиболее эффективно комбинируются АО с сопоставимой энергией и симметрией.
5. Прочность связи пропорциональна степени перекрывания АО.

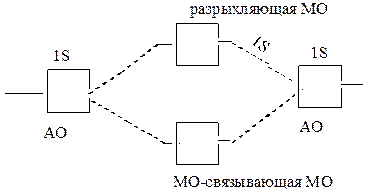
Метод МО объясняет возможность образования химической связи не только парой, но и одним электроном.
При образовании химической связи возможно несколько случаев перекрытия электронных орбиталей.
σ-связь образована перекрыванием АО по линии соединяющей ядра взаимодействующих атомов:
 |

π-связь образована перекрыванием АО по обе стороны линии, соединяющей ядра атомов:
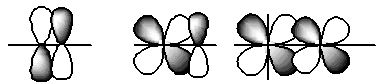
p p d p d d
δ-связь образована перекрыванием орбиталей в четырех точках.
Соотношение энергий и длины связей следующее: Еπ связи < Еσ связи;
Едвойной связи > Еодинарной связи; lдвойной < lодинарной. Кратные связи образуются при наложении на σ-связь, π и δ-связей.
Гибридизация АО– выравнивание различных АО по энергии и по внешнему виду. Углерод при получении энергии извне образует четыре не спаренных электрона путем перехода одного электрона с 2s подуровня на 2р:
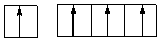 S1 + P3
S1 + P3
При образовании метана происходит смешивание этих четырех АО с образованием равноценных орбиталей по энергии и внешнему виду:
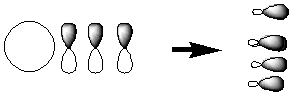
В данном случае имеет место sp3-гибридизация. Возможны sp2, sp и другие более сложные виды гибридизации АО.
Пространственная структура молекул.АО располагаются в пространстве таким образом, чтобы энергия отталкивания между электронами, находящимися на АО, была наименьшая.
Пространственная структура молекул определяется числом электронов участвующих в образовании химической связи, и ее направленностью.
1. Двуцентровые системы линейны.
2. Если на внешней оболочке атома имеется 2 неспаренных электрона (р-элементы VI группы – O, S, Te), то при их перекрывании с АО другого атома образуется угловая система, в которой угол между линями, соединяющими ядра трех атомов, равен 90°. Из-за отталкивания электронов угол несколько больше 90°, и для воды он равен 105°.
3. Гибридизация АО определяет пространственную конфигурацию:
sp – линейная, sp2 – угол примерно равен 120° (треугольная – молекула плоская), sp3 – гибридизация (молекула имеет объемное строение).
Полярность молекул характеризуется значением дипольного момента, равного произведению заряда на расстояние между зарядами.
Металлическая связь. Элементы-металлы образуют простые вещества-металлы за счет связи, называемой металлической. В атомах металлов малое число валентных электронов, слабо связанных с ядром, сочетается с наличием вакантных, близких по энергии орбиталей во внешнем слое. Эта особенность определяет возможность свободного перемещения электронов с одной орбитали на другую, за счет которого осуществляется связь между всеми атомами кристалла металла. Металлическую связь можно рассматривать как предельно делокализованную ковалентную, когда электроны, осуществляющие связь, обобществлены множеством ядер («электронный газ»). Связь положительных ионов, расположенных в узлах кристаллической решетки и обобществленных электронов, называется металлической.
Этой связью объясняются физические свойства металлов: блестящий вид, пластичность, теплопроводность, электропроводность.
Межмолекулярное взаимодействие. В 1873 г. голландец Ван-дер-Ваальс предположил, что существуют силы, обусловливающие притяжение между молекулами. Они получили название Ван-дер-Ваальсовы силы и включают 3 составляющие:
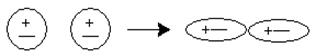
· диполь-дипольное взаимодействие (так называемое ориентационное взаимодействие);
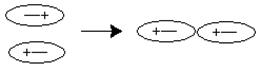
· индукционное взаимодействие; под действием дипольного момента одной молекулы возникает наведенный дипольный момент у другой;
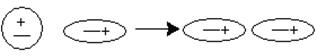
· дисперсионное взаимодействие (возникают мгновенные диполи, т.е. электроны соседних молекул двигаются согласованно).
Энергия Ван-дер-Ваальсового взаимодействия обратно пропорциональна расстоянию между центрами в шестой степени и, следовательно, на порядок ниже энергии химической связи. Силы Ван-дер-Ваальсового взаимодействия увеличиваются с возрастанием числа электронов в молекуле, т.е. с увеличением молекулярной массы. Наличие этих сил обуславливает возможность образование жидкого состояния у газов (в том числе у благородных газов) и отклонение реальных газов от уравнения Менделеева-Клайперона.
Уравнение Менделеева-Клайперона pV = ν R T применим только к идеальным газам, т.е. к газам для которых можно применять следующие допущения:
· молекула газа не имеет размера;
· между молекулами отсутствует взаимодействие.
В реальных газах эти условия не выполнимы и для их описания используется уравнение Ван-дер-Ваальса (для одного моля газа):
(p + pвн) (V – b) = RT,
где pвн – внутреннее давление (учитывает взаимное притяжение молекул), b - коэффициент учитывающий собственный размер молекул.
Водородная связьобусловлена спецификой строения атома водорода (имеется только один электрон).Водородная связь – взаимодействие, возникающее между атомом Н, связанным с атомом элемента с высокой электроотрицательностью (F, O, N, Cl) в составе одной группы, и электроотрицательным атомом, входящим в состав другой группы. Если обе эти группы входят в состав одной молекулы, то водородную связь называют внутримолекулярной (а), если разных, томежмолекулярной (б, в).
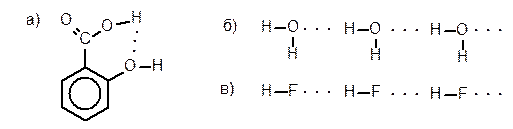
Рассматривать водородную связь только как «слабую» ионную связь за счет электростатического притяжения атома водорода, имеющего заряд +d, и атома электроотрицательного элемента другой группы, имеющего заряд -d, нельзя, т.к. водородная связь имеет признаки ковалентной связи – направленность и насыщаемость. Ковалентный характер водородной связи согласуется с наличием донорно-акцепторного взаимодействия между атомом водорода (акцептор) и электроотрицательным атомом (донор электронной пары), которому способствует существующее разделение зарядов. Таким образом, водородную связь следует рассматривать как суперпозицию электростатического и донорно-акцепторного взаимодействия.
Даже в парах воды есть димеры. Энергия водородной связи имеет промежуточные значения между энергией ковалентной связи и энергией Ван-дер-Ваальсового взаимодействия.
Наличие водородной связи приводит к увеличению вязкости и температуры кипения, объясняет аномально высокую плотность и теплоемкость, отражается на растворимости вещества.
Дата добавления: 2015-08-26; просмотров: 1853;
