Правила заполнения электронами уровней и подуровней.
Принцип Паули: «в атоме не может быть двух электронов в одинаковых квантовых состояниях».
Из этого вытекает, что на s подуровне может располагаться только два электрона, на р подуровне 6, на d подуровне 10 и т.д. с антипараллельным спином. Maксимальное число электронов на уровне равно 2n2, а на подуровне – 2∙(2l+1).
Принцип наименьшей энергии: электроны в основном состоянии атома заполняют орбитали с меньшим значением энергии. Энергия подуровня определяется по сумме «n+l» (I правило Клечковского). Если для нескольких подуровней «n+l» одинокого, то в первую очередь заполняется подуровень с меньшим значением «n», после его заполнения, заполняется подуровень с большим значением «n» (II правило Клечковского), т.е.
1s22s22p63s23p64s23d104p65s24d105p66s25d14f145d96p67s26d15f146d10.
Правило Гунда (Хунда): электроны заполняют подуровни таким образом, чтобы сумма спиновых квантовых чисел на подуровне была максимальной.
Электронные и графические формулы атомов.
Электронная конфигурация атома элемента – это запись распределения электронов по уровням, подуровням и орбиталям с учетом изложенных правил заполнения.
Азот: атомный номер 7, число электронов в атоме 7, период 2 (n=2), группа 5. Азот имеет электронную конфигурацию 1s22s22p3. Три электрона 2p-подуровня должны располагаться поодиночке на каждой из трех 2p-орбиталей и иметь параллельные спины.
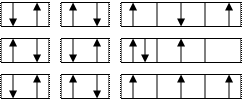
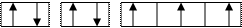 1s 2s 2p
1s 2s 2p
1s 2s 2p
разрешенная конфигурация
атома азота
неразрешенная конфигурация
атома азота.
У некоторых атомов (Сu, Ag, Au, Cr, Mo) наблюдается «провал» или проскок электрона с s-подуровня внешнего уровня на не полностью заполненный d-подуровень.
Дата добавления: 2015-08-26; просмотров: 1866;
