Квантовые числа. 1. Главное квантовое число n (n = от 1 до ¥ ) определяет энергию электрона (ē) на уровне в атоме
1. Главное квантовое число n (n = от 1 до ¥ ) определяет энергию электрона (ē) на уровне в атоме, Е = –A/n2 и радиус наибольшей вероятности его нахождения r = n2/B (где А и В – постоянные для данного атома химического элемента, зависимые только от заряда ядра).
2. Орбитальное квантовое число (l = 0, 1, 2,…до (n–1)) определяет форму электронного облака и энергию электрона на подуровне:
| под уровень | s | p | d | f |
| l |
3. Магнитное квантовое число (m = –l, 0, +l) определяет расположение орбитали в пространстве.
Число возможных энергетических орбиталей на подуровне равно (2l+1). Графически атомная орбиталь изображается .
| Орбитальное квантовое число (l) | Магнитное квантовое число (m) | Число атомных орбиталей | |
| s | | ||
| p | –1,0,+1 | | |
| d | –2, –1, 0, +1, +2 | | |
| f | –3, –2, –1, 0, +1, +2, +3 | . |
4. Спиновое квантовое число (ms), 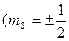 ). Упрощенно спин можно представить как характеристику собственного вращения электрона вокруг своей оси.
). Упрощенно спин можно представить как характеристику собственного вращения электрона вокруг своей оси.
Дата добавления: 2015-08-26; просмотров: 1120;
