Лекция 7. Растворы
Раствором называется гомогенная система (твердая, жидкая или газообразная), состоящая из двух или более компонентов. То вещество, которого больше, называют растворителем.
Процесс растворения твердого вещества сопровождается разрушением кристаллической решетки, что не наблюдается при растворении жидкости или газа. В растворе образуются сольваты или, для водных растворов, гидраты.
С термодинамической точки зрения процесс растворения есть самопроизвольный процесс и для него энергия Гиббса меньше нуля (ΔG = (ΔH – ТΔS) < 0). Следовательно, самопроизвольное растворение твердого вещества возможно, если ΔH < 0 (энтальпийный фактор – химическая теория растворов), т.е. если система, в данном случае раствор, будет обладать меньшей величиной ΔH, чем суммарная величина ΔH растворителя и растворенного вещества в отдельности, и если ΔS > 0 (энтропийный фактор – физическая теория растворов), т.е. при растворении возрастает беспорядок в системе. В некоторых случаях образование раствора происходит и тогда, когда ΔH > 0, но при этом произведение
ТΔS > ΔH, т.е. энтропийный фактор преобладает над энатальпийным. Если при образовании раствора ΔH = 0, т.е. взаимодействие между молекулами растворителя и растворенного вещества точно такое же, как и между молекулами растворителя, то образуется так называемый идеальный раствор. В данном случае образование раствора происходит за счет увеличения энтропии (ΔS > 0)
Состав раствора выражается несколькими видами концентраций (таблица 2).
Растворимость–это способность вещества растворяться в определенном растворителе. Мерой растворимости является коэффициент растворимости– это масса безводного вещества, которая может раствориться с образованием насыщенного раствора в 100 г растворителя при данной температуре. Насыщенный раствор находится в равновесии с осадком растворенного вещества. Пересыщенный раствор содержит больше вещества, чем это определяется его растворимостью. Ненасыщенный раствор содержит меньше вещества, чем это определяется его растворимостью.
Растворимость зависит от следующих факторов: а) природа вещества; б) природа растворителя; в) внешние условия (температура, давление и др).
Природа вещества.Существуют растворимые (более 1 г на 100 г воды, NaCl), малорастворимые (от 0,1 до 1 г на 100 г воды, Ca(OH)2), практически нерастворимые (менее 0,1 г на 100 г воды, CaCO3) вещества. Абсолютно нерастворимых веществ нет.
Природа растворителя. Подобное растворяется в подобном. Соединения с ионным типом связей (соли, щелочи) хорошо растворяются в полярных растворителях (вода), неполярные молекулы (кислород) – в неполярных растворителях.
Таблица 2
Уравнения для расчета концентрации раствора
| Массовая доля | Отношение массы растворенного вещества А в 100 единицах массы раствора | 
|
| Молярная концентрация | Количество молей растворенного вещества А, содержащихся в 1 л раствора | 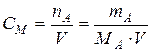 [моль/л]
[моль/л]
|
| Нормальная концентрация | Количество моль-эквивалентов растворенного вещества А, содержащихся в 1 л раствора | 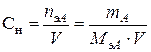 [моль/л]
[моль/л]
|
| Моляльная концентрация | Количество молей вещества А, растворенного в 1 кг растворителя В | 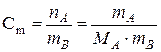 [моль/кг]
[моль/кг]
|
| Мольная доля | Отношение числа молей растворенного вещества А к общему числу молей всех веществ, содержащихся в растворе | 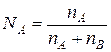 ,
где ,
где 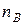 – количество вещества растворителя В – количество вещества растворителя В
|
Температура. Если при растворении вещества происходит поглощение тепла, т.е. процесс растворения эндотермический, то с повышением температуры растворимость веществ увеличивается. Если при растворении вещества происходит выделение тепла, т.е. процесс растворения экзотермический, то с повышением температуры растворимость веществ уменьшается. С повышением температуры взаимная растворимость жидкостей увеличивается. Растворимость газов при увеличении температуры уменьшается.
Давление существенно не влияет на растворимость твердых и жидких веществ, но сильно влияет на растворимость газов. Зависимость растворимости газов от давления выражается законом Генри:растворимость газа при постоянной температуре прямо пропорциональна его парциальному давлению:
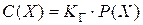 ,
,
где С(Х) – концентрация газа в насыщенном растворе, моль/л; КГ – постоянная Генри для газа Х, моль/л×Па; P(X) – давление газа Х над раствором, Па.
Закон Генри справедлив лишь для газов, которые обладают низкой растворимостью и не взаимодействуют с растворителем. При растворении смеси газов растворимость каждого из них пропорциональна его парциальному давлению (закон Дальтона).
Растворы неэлектролитовобладают рядом свойств (коллигативные), которые зависят от концентрации находящихся в растворе веществ (таблица 3).
Осмос – самопроизвольный переход растворителя через полупроницаемую мембрану из области, где концентрация растворителя больше, в область, где его концентрация меньше.
Таблица 3
Коллигативные свойства растворов
| Первый закон Рауля | Относительное понижение парциального давления пара растворителя над разбавленным раствором равно мольной доле растворенного вещества |  ,
где р0 – давление насыщенного пара над чистым растворителем; р –давление насыщенного пара растворителя над раствором; nА и nВ – количество растворенного вещества и растворителя, соответственно (моль) ,
где р0 – давление насыщенного пара над чистым растворителем; р –давление насыщенного пара растворителя над раствором; nА и nВ – количество растворенного вещества и растворителя, соответственно (моль)
|
| Второй закон Рауля | Повышение температуры кипения (или понижение температуры замерзания) разбавленных растворов неэлектролитов пропорционально моляльности растворенного вещества | DТкр = К Сm, где Сm – моляльная концентрация растворенного вещества; К – криоскопическая постоянная для данного растворителя (для воды К = 1,86); DТкип = Е Сm, где Е – эбулиоскопическая постоянная для данного растворителя (для воды Е = 0,52) |
| Закон Вант-Гоффа | Осмотическое давление pосм численно равно тому давлению, которое оказывало бы растворенное вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объем, равный объему раствора | 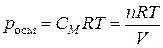 , или , или 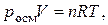 где СМ – молярная концентрация растворенного вещества, моль/л; n – количество растворенного вещества, (моль); R – универсальная газовая постоянная (8,31 Дж/моль К); Т – температура, К
где СМ – молярная концентрация растворенного вещества, моль/л; n – количество растворенного вещества, (моль); R – универсальная газовая постоянная (8,31 Дж/моль К); Т – температура, К
|
Дата добавления: 2015-08-26; просмотров: 2141;
