Лекция 8. Растворы электролитов
По способности проводить электрический ток в водном растворе или в расплаве вещества делятся на электролиты и неэлектролиты. Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся соли, кислоты, основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи.
Неэлектролитами называются вещества, растворы или расплавы которых не проводят электрический ток. К ним относятся, например, кислород, водород и многие органические вещества (сахар, эфир, бензол и др.). В молекулах этих веществ существуют ковалентные неполярные или малополярные связи.
Для объяснения электропроводности растворов и расплавов солей, кислот и оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации (1887).
1. Молекулы электролитов при растворении или расплавлении распадаются на ионы (электролитическая диссоциация). Ионы – это атомы или группы атомов, имеющие положительный или отрицательный заряд.
2. В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы движутся к положительно заряженному электроду (аноду). Поэтому положительные ионы называются катионами, отрицательные ионы – анионами. К катионам относятся: ион водорода Н+, ион аммония NH4+, ионы металлов Na+, K+, Fe2+, А13+, катионы основных солей CuOH+, А1(ОН)2+, FeOH2+ и т.д. К анионам относятся: гидроксид-ион ОН–, ионы кислотных остатков Сl– NO3–, SO42–, Сг2О72–, анионы кислых солей НСО3–, Н2РО4– и т.д.
3. Диссоциация – процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (ионизация, или диссоциация) и соединение ионов в молекулы (ассоциация, или моляризация).
Диссоциацию молекул электролитов выражают уравнениями, в которых вместо знака равенства ставят знак обратимости ( 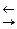 ). В левой части уравнения записывают формулу молекулы электролита, в правой – формулы ионов, которые образуются в процессе электролитической диссоциации. Например:
). В левой части уравнения записывают формулу молекулы электролита, в правой – формулы ионов, которые образуются в процессе электролитической диссоциации. Например:
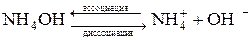 .
.
Каждая молекула гидроксида аммония диссоциирует на ион аммония и ион гидроксида. Следовательно, в результате диссоциации одной молекулы образуется два иона. Общая сумма зарядов катионов равна общей сумме зарядов анионов и противоположна по знаку (т.к. растворы электролитов электронейтральны).
Механизм электролитической диссоциации. Гидратация ионов.Причины и механизм диссоциации электролитов объясняются химической теорией растворов Д. И. Менделеева и природой химической связи. Растворители, в которых происходит диссоциация, состоят из полярных молекул (вода). Химическая теория растворов основана на представлении об определяющей роли явления сольватации при растворении веществ. Сольватация – процесс химического взаимодействия частиц растворенного вещества с молекулами растворителя, приводящий к образованию сольватов (гидратов, если растворителем является вода). Диссоциация электролитов с ионной и полярной связями протекает не одинаково. В растворах электролитов все ионы находятся в гидратированном состоянии. Растворение электролита можно представить в виде процесса, включающего следующие стадии:
1) ориентация вокруг частиц растворенного вещества полярных молекул растворителя;
2) поляризация молекул (частиц) растворенного вещества под действием полярных молекул растворителя;
3) разрыв связей между частицами растворенного вещества с образованием сольватированных ионов.
Степень диссоциации. В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично, часть их молекул остается в растворе в недиссоциированном виде. Число, показывающее, какая часть молекул распалась на ионы, называется степенью электролитической диссоциации (степенью ионизации).
Степень электролитической диссоциации (a) равна отношению числа молекул, которые распались на ионы, к общему числу молекул в растворе:
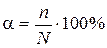 ,
,
где n – число молекул, распавшихся на ионы; N – общее число растворенных молекул.
В зависимости от значения степени диссоциации все электролиты условно делят на три группы: a > 30% – сильные, a < 3% – слабые и средней силы 3% < a < 30%.
Степень диссоциации зависит от природы растворителя и природы растворяемого вещества, концентрации раствора, температуры и других факторов. В первом приближении можно сказать, что в воде диссоциируют полностью те вещества, в молекуле которых имеется ионная связь. Если связь полярная, то диссоциация будет частичной, а если связь неполярная, то диссоциация будет отсутствовать.
При уменьшении концентрации слабого электролита, т.е. при разбавлении раствора, степень диссоциации увеличивается. При повышении температуры степень диссоциации, как правило, увеличивается.
Константа диссоциации (ионизации).Для характеристики слабых электролитов применяют константу диссоциации (Кд). В растворах слабых электролитов устанавливается динамическое равновесие между недиссоциированными молекулами и ионами:
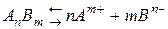 .
.
Применяя закон действующих масс, запишем выражение константы равновесия:
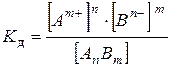 ,
,
где [Am+], [Bn–] и [AnBm] – равновесные концентрации ионов Аm+ и Вn– и недиссоциированных молекул AnBm,соответственно.
Для слабого электролита константа диссоциации – постоянная величина, не зависящая от концентрации раствора. Константа диссоциации зависит от природы электролита, природы растворителя и температуры.
Кислоты, основания и соли в свете теории диссоциации электроли- тов. Амфолиты. В свете теории электролитической диссоциации приняты следующие определения классов веществ:
· кислотой называется соединение, диссоциирующее в водном растворе на ионы водорода и ионы кислотного остатка: HNO3 → H+ + NO3–;
· oснованием называется соединение, диссоциирующее в водном растворе на ионы гидроксильных групп и ионы металла (или ион аммония):
Ba(OH)2 → Ba2+ + 2OH–;
· солями называются соединения, диссоциирующие в водном растворе на ионы металла и ионы кислотного остатка: Na2SO4 → 2Na+ + SO42–.
Если при растворении соли в растворе присутствуют ионы водорода, ионы металла и ионы кислотного остатка, то такая соль называется кислой. Если при растворении соли в растворе присутствуют ионы гидроксильных групп, ионы металла и ионы кислотного остатка, то такая соль называется основной.
Существуют электролиты, способные диссоциировать и как кислоты (с отщеплением ионов водорода), и как основания (с отщеплением гидроксильных групп):
2H+ + ZnO22– ← Zn(OH)2 → Zn2+ + 2OH–
2H+ + 2OH– ← 2HOH → H3O+ + OH– или HOH → H+ + OH–.
Такие электролиты называются амфолитами.
Ионное произведение воды, рН раствора.Для реакции диссоциации воды HOH ↔ H+ + OH– константа равновесия определяется следующим уравнением: К = [H+] [OH–] / [H2O]. Концентрация воды в водных растворах практически не меняется и вводится в константу равновесия (Кw).
Кw = [H+] [OH–] = К [H2O].
Полученную константу (Кw) для воды называют ионным произведением воды,которое зависит только от температуры (Кw = 10–14). При диссоциации воды на каждый ион Н+ образуется один ион ОН–. Следовательно, в чистой воде концентрации этих ионов одинаковы: [Н+] = [ОН–]. Используя значение ионного произведения воды, находим [Н+] = [ОН–] = 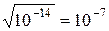 моль/л. Таковы концентрации ионов Н+ и ОН– в чистой воде. При добавлении соляной кислоты, которая диссоциирует в воде на ионы Н+ и Сl–, концентрация ионов Н+ в растворе увеличится, но ионное произведение воды от концентрации не зависит – в таком случае уменьшается концентрация [ОН–]. Напротив, если к воде добавить щелочь, то концентрация [ОН–] увеличится, а [Н+] уменьшится. Концентрации [Н+] и [ОН–] взаимосвязаны: чем больше одна величина, тем меньше другая, и наоборот.
моль/л. Таковы концентрации ионов Н+ и ОН– в чистой воде. При добавлении соляной кислоты, которая диссоциирует в воде на ионы Н+ и Сl–, концентрация ионов Н+ в растворе увеличится, но ионное произведение воды от концентрации не зависит – в таком случае уменьшается концентрация [ОН–]. Напротив, если к воде добавить щелочь, то концентрация [ОН–] увеличится, а [Н+] уменьшится. Концентрации [Н+] и [ОН–] взаимосвязаны: чем больше одна величина, тем меньше другая, и наоборот.
Кислотность растворов обычно выражают через концентрацию ионов Н+. В кислых растворах [Н+] > 10–7 моль/л, в нейтральных [Н+] = 10–7 моль/л, в щелочных [Н+] < 10–7 моль/л.
Чтобы не писать числа с показателем степени, кислотность раствора часто выражают через отрицательный логарифм концентрации ионов водорода,называя эту величину водородным показателем и обозначая ее рН:
рH = –lg[H+].
В кислых растворах рН < 7, в нейтральных рН = 7, в щелочных рН > 7.
Взаимосвязь между константой и степенью диссоциации.В. Оствальдом при a << 1 получено уравнение (закон разбавления)
a = (Кд / С)1/2, 
из которого следует, что с увеличением разбавления, т.е. уменьшения концентрации, степень диссоциации возрастает.
Ступенчатая диссоциация. Многоосновные кислоты и многокислотные основания диссоциируют ступенчато, последовательно отщепляя ионы водорода или ионы гидроксильных групп. Каждая ступень диссоциации характеризуется своим значением константы диссоциации. Легче всего происходит отщепление первого иона.
Активность электролитов.Поскольку при диссоциации число частиц в растворе возрастает, растворы электролитов обладают аномальными коллигативными свойствами. Уравнения, описывающие коллигативные свойства неэлектролитов, можно применить и для описания свойств идеальных растворов электролитов, если ввести поправочный так называемый изотонический коэффициент (i), например:
πосм. = iCRT , ΔTзам. = iKm или ΔTкип. = iЕm.
Изотонический коэффициент связан со степенью диссоциации электролита:
i = 1+ (n-1) α ,
где n – количество ионов, образующихся при диссоциации одной молекулы.
Термодинамические свойства реальных растворов описываются уравнениями, в которых вместо концентраций вводится активность. Активность иона ai выражается в виде произведения концентрации иона сi на его коэффициент активности γi: ai = γi сi . Экспериментально определить можно только среднюю активность катиона a+ и аниона a–. Коэффициенты активности ионов не зависят от конкретного вида ионов, находящихся в растворе, а зависят от присутствия и других ионов, т.е. от ионной силы (I) раствора:
I = 0,5Σ cizi2,
где zi – заряд иона (в единицах заряда протона); сi – его молярная концентрация.
Таким образом, активность и коэффициент активности учитывают межионное взаимодействие в растворе.
Дата добавления: 2015-08-26; просмотров: 3506;
