Схема трансформации одного изомера хелата меди в другой.
Помимо квадрата и тетраэдра возможны и другие варианты аллогональных изомеров - додекаэдр и квадратная антипризма, существующие в разных условиях и переходящие друг в друга. Так, если комплекс с ионом [Mo(CN)8]4– находится в твердом состоянии, этот анион представляет собой додекаэдр, а если в водном растворе - квадратную антипризму:
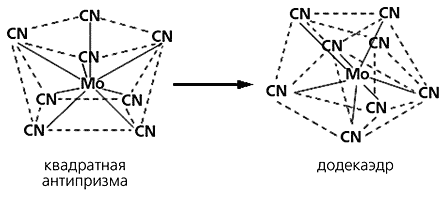
Превращение аллогональных изомеров.
Спиновая изомерия. Спиновые изомеры - это координационные соединения, у которых в зависимости от температуры или каких-либо иных факторов изменяется лишь число неспаренных электронов, тогда как все остальное (стехиометрический состав, лиганды, их взаимное расположение в пространстве и даже геометрия координационного многогранника) одинаково. Примеры таких соединений - хелаты железа(III) c тио- или селеносемикарбазонами:
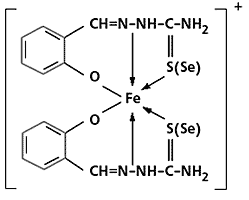
Изомер, который содержит один неспаренный электрон, существует при низкой (<270 К) температуре, а второй, с пятью такими электронами, - при высокой. Окраской эти изомеры тоже отличаются друг от друга, и это вполне понятно, если учесть, что набор разрешенных электронных переходов, ответственных за цвет в видимой области спектра, у них резко различен.
Ионизационная изомерия. Эта форма изомерии состоит в различном распределении ионов между внутренней и внешней сферой: темно- фиолетовый [Co(NH3)5Br]SO4 и красно-фиолетовый [Co(NH3)5SO4]Br.
Гидратная изомерия. Обусловлена различным распределением молекул воды во внутренней и внешней сфере: [Co(H2O)5Cl]Cl2·H2O и [Co(H2O)4Cl2]Cl·2H2O.
Связевая изомерия. Некоторые лиганды могут связываться двумя различными способами, тем самым создавая возможность существования изомеров, например: [(CO)5Mn—SCN] и [(CO)5Mn—NCS].
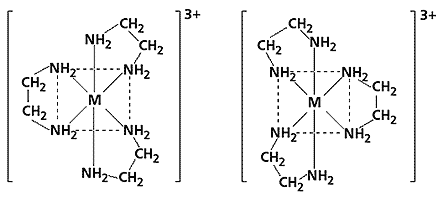
Оптическая изомерия. Оптическими изомерами называются комплексные соединения, одно из которых является зеркальным отражением другого. Оптическая изомерия характеризуется способностью вращать плоскость поляризации плоскополяризованного света. Два изомера отличаются друг от друга направлением вращения плоскости поляризации: один называют правым (d), другой – левым (l) изомером. Правые и левые изомеры оказываются зеркальными изображениями друг друга и не могут быть совмещены в пространстве. Хорошо изучена оптическая изомерия для трис-комплексов [ML3]3+, в которых центральным атомом служит трехвалентный металл (хром, кобальт, родий или иридий), а лигандом - 1,2-этилендиамин.
Дата добавления: 2015-07-30; просмотров: 1216;
