Гидролиз как процесс комплексообразования.
При взаимодействии с водой любая соль металла превращается во внутрисферный гидрат. Например, безводный хлорид алюминия AlCl3 при растворении в воде образует координационное соединение, во внутренней сфере которого находятся молекулы воды: [Al(H2O)6]3+. Под действием положительного заряда центрального атома вода, вошедшая в координационную сферу иона Al3+ поляризуется и приобретает более «кислые» свойства, чем обычная вода (рКдисH2Oсвоб » 17, рКдисH2Oкоорд » 5). Поэтому координационно связанная вода диссоциирует в большей степени, чем обычная. В результате отщепляется протон и H2O превращается в ион гидроксила:
[Al(H2O)6]3+ 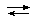 [Al(H2O)5(OH)]2+ + H+
[Al(H2O)5(OH)]2+ + H+
Среда становится кислая из-за возрастания концентрации ионов водорода. В общем случае гидролиз солей слабых оснований и сильных кислот для первой стадии описывается уравнением:
[M(H2O)x]n+  [M(H2O)x-1(OH)]n-1 + H+
[M(H2O)x-1(OH)]n-1 + H+
Таким образом, начало гидролиза объясняется с данной точки зрения поляризационным воздействием иона металла на внутрисферную воду. Очевидно, что не все молекулы воды, входящие в координационную сферу подвергаются гидролитическому расщеплению. Замена молекулы воды гидроксилом с превращением [M(H2O)x]n+ в [M(H2O)x-1(OH)]n-1 резко понижает поляризующие действие катиона из-за частичной нейтрализации его положительного заряда отрицательным зарядом иона гидроксила. Вода в таком комплексе [M(H2O)x-1(OH)]n-1 уже менее сильная кислота, чем в исходном гексагидрате, поэтому вторая ступень гидролиза протекает в меньшей степени, и при более высоком разведении раствора.
Известны мостиковые гидроксокомплексы с одной, двумя и тремя мостиковыми гидроксогруппами:
OH

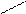 [(NH3)5Cr Cr(NH3)5]Cl5
[(NH3)5Cr Cr(NH3)5]Cl5
Наиболее распространены дигидроксомостиковые комплексы, которые известны для большинства переходных металлов в состоянии окисления +2 и выше. Эти мостиковые соединения содержат конфигурацию четырехчленного цикла:
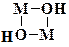
 Образование цикла приводит к значительной стабилизации димерного комплекса. Об этом свидетельствуют высокие значения констант димеризации (102 – 105), отвечающих равновесию:
Образование цикла приводит к значительной стабилизации димерного комплекса. Об этом свидетельствуют высокие значения констант димеризации (102 – 105), отвечающих равновесию:
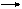 2[M(H2O)x-1(OH)](n-1)+ M(H2O)x-1(OH)2M(H2O)x-1]2(n-l)+
2[M(H2O)x-1(OH)](n-1)+ M(H2O)x-1(OH)2M(H2O)x-1]2(n-l)+
Например, структуру комплексного иона [Co4(OH)6(NH3)12]6+ представляют следующим образом:
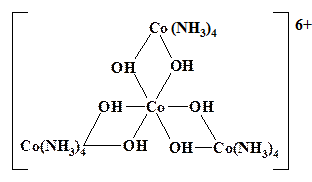
Представляет интерес структура тримерного иона [Sn3(OH)4]2+, которая выглядит как:
В заключение следует подчеркнуть, акво- и гидроксокомплексы образуют практически все элементы периодической системы, можно сказать, что они являются наиболее распространенными координационными соединениями.
Дата добавления: 2015-07-30; просмотров: 2226;
