Константы нестойкости некоторых комплексных ионов
| Комплексный ион | Kнест | Комплексный ион | Kнест |
| [Co(NH3)6]2+ | 7,75 • 10–6 | [Zn(OH)4]2– | 3,6 • 10–16 |
| [Ag(NH3)2]+ | 1,07 • 10–7 | [Fe(CN)6]3– | 1,0 • 10–31 |
| [Cu(NH3)4]2+ | 2,14 • 10–13 | [Fe(CN)6]4– | 1,0 • 10–36 |
Образование прочных комплексных ионов может быть использовано для растворения труднорастворимых электролитов. Концентрация ионов в растворе определяется величиной произведения растворимости такого электролита. Добавляя в раствор вещества, образующие с одним из его ионов комплексное соединение, можно во многих случаях достичь растворения осадка за счет комплексообразования. Добиться этого тем легче, чем больше величина произведения растворимости и чем больше константа устойчивости комплексного иона.
Например, хлорид серебра AgCl растворяется в избытке аммиака, образуя [Ag(NH3)2]Cl. Растворимость AgCl в воде характеризуется величиной произведения растворимости:
AgCl(тв) 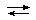 Ag+ + Cl¯ ПР = [Ag+][ Cl¯]= 1,8∙10–10
Ag+ + Cl¯ ПР = [Ag+][ Cl¯]= 1,8∙10–10
Ионы серебра ступенчато присоединяют молекулы аммиака:
[Ag(NH3) +]
 Ag+ + NH3
Ag+ + NH3  [Ag(NH3) +] ; K1 =
[Ag(NH3) +] ; K1 =
[Ag+][NH3]
[Ag(NH3)+] = K1[Ag+][NH3]
[Ag(NH3)2 +]
 [Ag(NH3)+] + NH3
[Ag(NH3)+] + NH3  [Ag(NH3)2+]; K2 =
[Ag(NH3)2+]; K2 =
[Ag(NH3)+][NH3]
[Ag(NH3)2+] = K1K2 [Ag+][NH3]2
Общая концентрация ионов серебра в растворе может быть представлена выражением:
СAg+ = [Ag+] + [Ag(NH3)+] + [Ag(NH3)2+] = [Ag+] + K1[NH3] + K1K2 [NH3]2
Подставим концентрацию ионов серебра, выраженную через СAg+ в выражение произведения растворимости:
ПР = [Ag+][Cl¯] = СAg+[Cl¯]
Растворимость хлорида серебра равна общей концентрации ионов серебра во всех формах, т.е. СAg+. Если хлорид-ионы присутствуют в системе лишь за счет растворенного AgCl, то СAg+ = Cl¯. В этом случае выражение растворимости принимает вид:
S = (ПР)1/2 = ([Ag+] + K1[NH3] + K1K2 [NH3]2)1/2
Если в системе наряду с аммиаком присутствуют хлорид-ионы, то расчет произведения растворимости нужно вести по формуле:
ПР
 S = ([Ag+] + K1[NH3] + K1K2 [NH3]2)
S = ([Ag+] + K1[NH3] + K1K2 [NH3]2)
[Cl-¯]
Менее растворимый AgI (ПРAgI = 1,1·10-16) в аммиаке практически не растворим, но растворяется в избытке раствора тиосульфата натрия Na2S2O3 по реакции:
AgI + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaI
поскольку β[Ag(S2O3)2]3– на несколько порядков больше β[Ag(NH3)2]+ (β[Ag(S2O3)2]3–= 1,0·10-13).
Разрушение комплексных соединений происходит при смещении равновесия его диссоциации и объясняется принципом Ле Шателье. При этом образуются соединения, в которых центральный атом или лиганд связаны более прочно, чем в исходном комплексе.
Например, при добавлении соляной кислоты к [Cu(NH3)4]Cl2 происходит разрушение комплекса, о чём свидетельствует изменения окраски раствора. Это связано с образованием катиона аммония, в котором аммиак связан с катионом водорода более прочно, чем с катионом меди:


[Сu(NH3)4]2+ 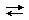 Cu2+ + 4NH3 + 4H+
Cu2+ + 4NH3 + 4H+  4NH4+ + Cu2+
4NH4+ + Cu2+
 |
β [Cu(NH3)4]2+ = 2∙10-13 β [NH4]+ = 6∙10-10
При избытке Н+

 На комплексообразование оказывают влияние и другие равновесия в водном растворе. К ним относятся реакции, сопровождающиеся образованием малорастворимых соединений.
На комплексообразование оказывают влияние и другие равновесия в водном растворе. К ним относятся реакции, сопровождающиеся образованием малорастворимых соединений.
 |

 [Cu(NH3)4]2+ 4NH3 + Cu2+ + S2– + CuS↓ + 4NH3
[Cu(NH3)4]2+ 4NH3 + Cu2+ + S2– + CuS↓ + 4NH3
 |
β [Cu(NH3)4]2+ = 2∙10-13 ПРCuS = 6∙10–36
При добавлении S2-
Это связано с тем, что ион меди(II) в ионе [Cu(NH3)4]2+ связан более прочно, чем в CuS.
Дата добавления: 2015-07-30; просмотров: 4973;
