Влияние комплексообразования на окислительно-восстановительные свойства центрального атома
Для полуреакции, в которой восстановленной формой является металл:
Mn+ + ne = Mo
уравнение Нернста имеет вид:
E = EoMn+/Mo + RT/nF ln [Mn+] , где
E0 – стандартный электродный потенциал, В;
R – универсальная газовая постоянная;
T – температура, К;
n – степень окисления иона;
F = 96450– число Фарадея;
[Mn+] – молярная концентрация ионов металла, моль/л.
Если известны последовательные константы образования комплексов, то можно рассчитать и электродный потенциал.
 Комплексообразование ионов металла лигандами может очень сильно влиять на термодинамическую устойчивость степени окисления металла. Например, сравним легкость перехода Fe(III) Fe(II) в зависимости от окружения иона металла:
Комплексообразование ионов металла лигандами может очень сильно влиять на термодинамическую устойчивость степени окисления металла. Например, сравним легкость перехода Fe(III) Fe(II) в зависимости от окружения иона металла:
[Fe(CN)6]3- + e = [Fe(CN)6]4- Eо = 0,36В;
[Fe(H2O)6]3+ + e = [Fe(H2O)6]2+ Eо = 0,77В;
[Fe(phen)3]3+ + e = [Fe(phen)6]2+ Eо = 1,12В;
где phen- фенантролин:
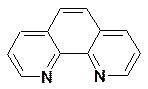
Чем больше значение окислительно-восстановительного потенциала (Eо), тем более сильным окислителем является окисленная форма. Аналогичная картина наблюдается и для соединений кобальта(III) и кобальта(II):
[Co(NH3)6]3+ + e = [Co(NH3)6]2+ Eо = 0,1В;
[Co(H2O)6]3+ + e = [Co(H2O)6]2+ Eо = 1,84В;
В аналитической химии реагентом для определения иона Fe2+ часто применяют красная кровяная соль K3[Fe(CN)6], а для определения иона Fe3+ - желтая кровяная соль. В обоих случаях в качестве продуктов реакции получаются ярко-синие вещества. Первое из них называют турнбулевой синью, а второе – берлинской лазурью. Впоследствии оказалось, что два последних вещества, по существу, являются одним и тем же соединением. В соответствии со значениями электродных потенциалов EoFe3+/Fe2+ = 0,77 В и
Eo[Fe(CN)6]3-/[Fe(CN)6]4-= 0,36 В. ионы F(III) должны окислять [Fe(CN)6]4-:
Таким образом, равновесие:
[Fe(CN)6]4- + Fe3+  Fe2+ + [Fe(CN)6]3-
Fe2+ + [Fe(CN)6]3-
будет сдвинуто в правую сторону. Смещению равновесия вправо способствует малая растворимость образующегося продукта. В осадок выпадают вещества, близкие по составу к KFeII[FeIII(CN)6].
Дата добавления: 2015-07-30; просмотров: 4720;
