Тертраэдрическое поле Сферическое поле Октаэдрическое поле
Таким образом, пятикратно вырожденные d-АО комплексообразователя, попадая в октаэдрическое поле лигандов, подвергаются расщеплению на две группы новых орбиталей – трехкратно вырожденные орбитали с более низкой энергией, d(xy), d(xz) и d(yz), и двукратно вырожденные орбитали с более высокой энергией, d(z2) и d(x2-y2). Эти новые группы d-орбиталей с более низкой и более высокой энергией обозначают dε и dγ.
Разность энергий двух новых подуровней de и dg получила название параметра расщепления D0:
E2 – E1 = D0
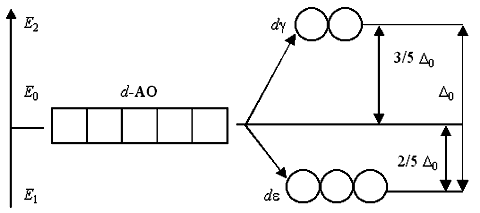
Если исходная d-АО заселена только частично и содержит от 1 до 6 электронов, и эти электроны размещаются только на de-АО, то мы получим значительный выигрыш энергии. Выигрыш энергии за счет преимущественного заселения электронами de-атомных орбиталей называют энергией стабилизации комплекса полем лигандов.
Специфика каждого из лигандов сказывается в том, какое поле данный лиганд создает – сильное или слабое. Чем сильнее поле лигандов, чем больше значение параметра расщепления D0.
Изучение параметра расщепления, как правило, основано на спектроскопических исследованиях. Длины волн полос поглощения комплексов l в кристаллическом состоянии или в растворе, обусловленные переходом электронов с de- на dg-АО, связаны с параметром расщепления D0 следующим образом:
n = 1/l; D0 = Е2 – Е1 = hn = h(c/l) = hcn,
где постоянная Планка h равна 6,626 ´ 10-34 Дж · с;
скорость света с = 3 ´ 1010 см/с.
Единица измерения D0 – та же, что у волнового числа n: см-1, что приближенно отвечает 12 Дж/моль.
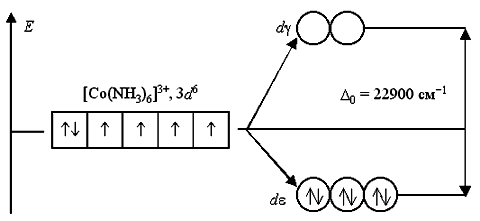
В ионе [Co(NH3)6]3+ лиганды NH3 создают сильное кристаллическое поле (D0 = 22900 см-1), все 3d6-электроны размещаются на более энергетически выгодной de-орбитали. Переход электронов с de- на dg-орбитали невозможен из-за слишком высокого энергетического барьера. Поэтому данный комплексный катион является низкоспиновым, он не содержит неспаренных электронов и диамагнитен.
Аналогичным образом могут быть представлены схемы распределения электронов по орбиталям в октаэдрическом поле для ионов [Fe(H2O)6]2+ и [Fe(CN)6]4-:
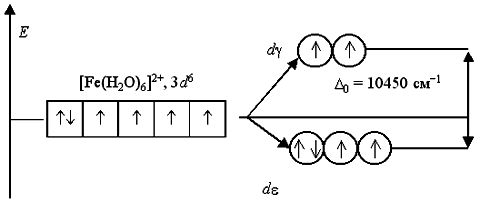
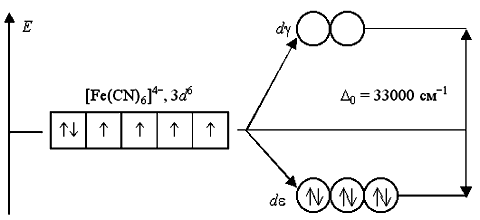
Зависимость D0 от природы лигандов более разнообразна. В результате исследования многочисленных комплексных соединений было установлено, что по способности увеличивать параметр расщепления металлов-комплексообразователей, находящихся в своих обычных степенях окисления, наиболее распространенные лиганды можно расположить в следующий спектрохимический ряд, вдоль которого значение D0 монотонно растет:
I- < Br- < Cl- » NCS- < < NO3- < F- < OH- < H2O » OH- < NH3 < NO2- < CN- » NO » CO.
Таким образом, наиболее сильное электростатическое поле вокруг комплексообразователя и самое сильное расщепление d-АО вызывают лиганды NO2-, CN- и CO.
Важно получить представление о порядке величин D0 = 10Dq.
Значения величин расщепления кристаллическим полем D0
| Электронная конфигурация | Ион | Лиганды | D0, см-1 | Спиновое состояние |
| d4 | Cr2+ | 6Н2О | в.с. | |
| Mn3+ | 6Н2О | в.с. | ||
| d5 | Mn2+ | 6Н2О | в.с. | |
| Fe3+ | 6Н2О | в.с. | ||
| d6 | Fe2+ | 6Н2О | в.с. | |
| 6CN- | н.с. | |||
| Co3+ | 6F- | в.с. | ||
| 6NH3 | н.с. | |||
| d7 | Co2+ | 6Н2О | в.с. |
Дата добавления: 2015-07-30; просмотров: 984;
