Теория валентных связей.
Теория валентных связей была первой из квантовомеханических теорий, использованной для приближенного объяснения характера химических связей в комплексных соединениях. В основе ее применения лежала идея о донорно-акцепторном механизме образования ковалентных связей между лигандом и комплексообразователем. Лиганд считается донорной частицей, способной передать пару электронов акцептору – комплексообразователю, предоставляющему для образования связи свободные квантовые ячейки (атомные орбитали) своих энергетических уровней:
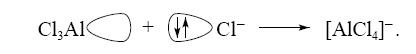
Для образования ковалентных связей между комплексообразователем и лигандами необходимо, чтобы вакантные s-, p- или d-атомные орбитали комплексообразователя подверглись гибридизации определенного типа. Гибридные орбитали занимают в пространстве определенное положение, причем их число соответствует координационному числу комплексообразователя.
Неподеленные пары электронов лигандов взаимодействуют с гибридными орбиталями комплексообразователя, и происходит перекрывание соответствующих орбиталей комплексообразователя и лиганда с появлением в межъядерном пространстве повышенной электронной плотности. Электронные пары комплексообразователя, в свою очередь, взаимодействуют с вакантными атомными орбиталями лиганда, упрочняя связь по дативномумеханизму. Таким образом, химическая связь в комплексных соединениях является обычной ковалентной связью, достаточной прочной и энергетически выгодной.
Электронные пары, находящиеся на гибридных орбиталях комплексообразователя, стремятся занять в пространстве такое положение, при котором их взаимное отталкивание будет минимально. Это приводит к тому, что структура комплексных ионов и молекул оказывается в определенной зависимости от типа гибридизации.
Например, катион [Zn(NH3)4]2+ включает комплексообразователь цинк(II). Электронная оболочка этого условного иона имеет формулу [Ar] 3d10 4s0 4p0 и может быть условно изображена так:
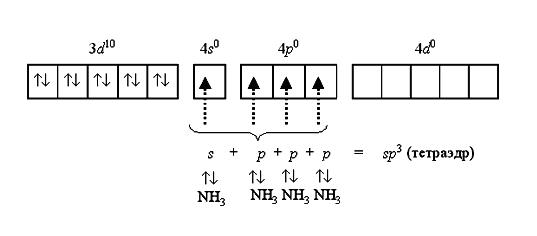
Вакантные 4s- и 4p-орбитали атома цинка(II) образуют четыре sp3-гибридные орбитали, ориентированные к вершинам тетраэдра. Каждая молекула аммиака имеет неподеленную пару электронов у атома азота. Орбитали атомов азота, содержащие неподеленные пары электронов, перекрываются с sp3-гибридными орбиталями цинка(II), образуя тетраэдрический комплексный катион тетраамминцинка(II) [Zn(NH3)4]2+:

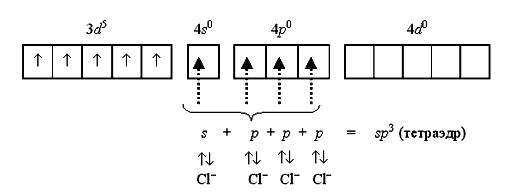
Тетрахлороманганат(II)-ион [MnCl4]2 содержит пять неспаренных электронов на 3d-орбитали и вакантные 4s- и 4p-орбитали. Вакантные орбитали образуют sp3-гибридные орбитали, которые перекрываются с p-атомными орбиталями хлорид-ионов:
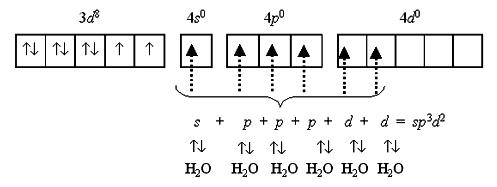
Октаэдрический комплекс никеля(II) [Ni(H2O)6]2+, хотя и парамагнитен, но достаточно устойчив. Его образование обусловлено sp3d2-гибридизацией атомных орбиталей никеля:
Октаэдрические комплексы кобальта [Co(NH3)6]2+ и [Co(NH3)6]3+.
Согласно методу валентных связей каждый лиганд является донором электронов. Он размещает свои электронные пары на свободных орбиталях центрального атома. Если это октаэдрический комплекс, как в нашем случае, то тип гибридизации должен быть d2sp3 или sp3d2.
Чтобы в комплексе [Co(NH3)6]3+ было возможно октаэдрическое (d2sp3) распределение шести лигандов, необходимо освободить две энергетические ячейки на 3d- подуровне иона Co3+. Энергетически это более выгодно сделать спаривая электроны на 3d- подуровне, [Co(NH3)6]3+ :
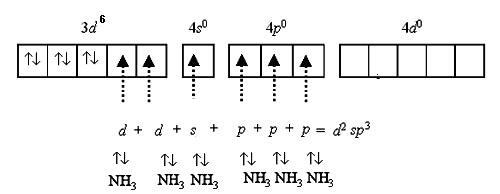
Лишний электрон в комплексе Co2+ по сравнению с Co3+ мешает образованию d2sp3- гибридизации, поэтому образуется комплекс с sp3d2- гибридизацией с участием внешних орбиталей, [Co(NH3)6]2+:

Естественно, что внешне орбитальный характер связей делает аммиакат [Co(NH3)6]2+ менее устойчивым, чем [Co(NH3)6]3+. Поэтому константы нестойкости этих комплексов очень сильно различаются:
b [Co(NH3)6]2+ = 7,8·10-6 , b[Co(NH3)6]3+ = 7,1·10-36
Если в гибридизации участвуют атомные орбитали внешнего d-подуровня, комплекс, как правило, в значительной степени парамагнитен и называется внешнеорбитальным или высокоспиновым. Строение таких комплексов может отвечать типу гибридизации, например, sp3d2.
Такие комплексы, при образовании которых имеет место гибридизация с участием атомных орбиталей предвнешнего d-подуровня, называются внутриорбитальными или низкоспиновыми и, как правило диамагнитны или слабо парамагнитны (все или почти все электроны комплексообразователя спарены, а тип гибридизации, например, d2sp3 или dsp2).
Теория кристаллического поля.
Теория кристаллического поля пришла на смену теории валентных связей в 40-х годах XX столетия. В чистом виде она сейчас не применяется, так как не может объяснить образование ковалентных связей в комплексных соединениях и совершенно не учитывает истинного состояния лигандов (например, их действительных размеров) даже в случае взаимодействий, близких к чисто электростатическим.
Уже с середины 50-х годов упрощенная теория кристаллического поля была заменена усовершенствованной теорией поля лигандов, учитывающей ковалентный характер химических связей между комплексообразователем и лигандом.
Однако наиболее общий подход к объяснению образования комплексных соединений дает теория молекулярных орбиталей (МО), которая в настоящее время превалирует над всеми остальными. Метод молекулярных орбиталей предусматривает и чисто электростатическое взаимодействие при отсутствии перекрывания атомных орбиталей, и всю совокупность промежуточных степеней перекрывания.
Рассмотрим основные понятия теории кристаллического поля, которая, как и теория валентных связей, все еще сохраняет свое значение для качественного описания химических связей в комплексных соединениях из-за большой простоты и наглядности.
В теории кристаллического поля химическая связь комплексообразователь – лиганд считается электростатической. В соответствии с этой теорией лиганды располагаются вокруг комплексообразователя в вершинах правильных многогранников (полиэдров) в виде точечных зарядов. Реальный объем лиганда теорией во внимание не принимается.
Лиганды, как точечные заряды, создают вокруг комплексообразователя электростатическое поле (“кристаллическое поле”, если рассматривать кристалл комплексного соединения, или поле лигандов), в котором энергетические уровни комплексообразователя и прежде всего d-подуровни расщепляются, и их энергия изменяется. Характер расщепления, энергия новых энергетических уровней зависит от симметрии расположения лигандов (октаэдрическое, тетраэдрическое или иное кристаллическое поле ). Когда в качестве лигандов координируются молекулы H2O, NH3, CO и другие, их рассматривают как диполи, ориентированные отрицательным зарядом к комплексообразователю.
Рассмотрим случай октаэдрического расположения лигандов (например, [CoF6]3- или [Co(NH3)6]3+). В центре октаэдра находится атом-комплексообразователь М(+n) с электронами на d-атомных орбиталях, а в его вершинах – лиганды в виде точечных отрицательных зарядов (например, ионы F- или полярные молекулы типа NH3). В условном ионе М(+n), не связанном с лигандами, энергии всех пяти d-АО одинаковы (т.е. атомные орбитали вырожденные).
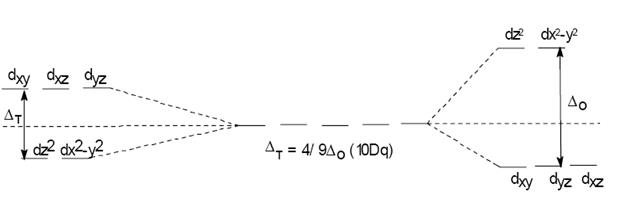
Однако в октаэдрическом поле лигандов d-АО комплексообразователя попадают в неравноценное положение. Атомные орбитали d(z2) и d(x2- y2), вытянутые вдоль осей координат, ближе всего подходят к лигандам. Между этими орбиталями и лигандами, находящимися в вершинах октаэдра, возникают значительные силы отталкивания, приводящие к увеличению энергии орбиталей. Иначе говоря, данные атомные орбитали подвергаются максимальному воздействию поля лигандов.
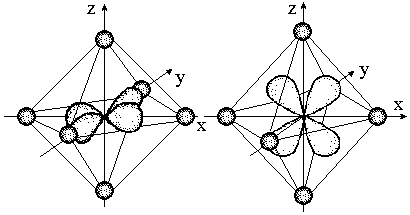
Орбитали dх2-у2 (а) и dxz (б) в октаэдрическом поле лигандов
Другие три d-АО – d(xy), d(xz) и d(yz), расположенные между осями координат и между лигандами, находятся на более значительном расстоянии от них. Взаимодействие таких d-АО с лигандами минимально, а, следовательно – энергия d(xy), d(xz) и d(yz)-АО понижается по сравнению с исходной.
Дата добавления: 2015-07-30; просмотров: 3983;
