Поняття ідеального газу та його закони
Ідеальний – це газ, в якому нехтують власним об’ємом молекул і силами взаємодії між ними.
Стан газу характеризується такими величинами: m – маса, P – тиск,V –об’єм,T – абсолютна температура. Закони ідеального газу встановлюють зв’язок між цими параметрами.
Ізотермічний закон (закон Бойля-Маріотта) m = const, T= const: при незмінній масі і температурі добуток тиску на об’єм залишається незмінним
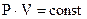 . (6.1)
. (6.1)
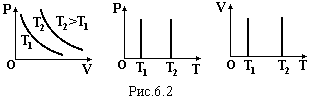 Графіки цього закону зображені на рис.6.2 в різних координатах.
Графіки цього закону зображені на рис.6.2 в різних координатах.
 |
Ізобарний закон (закон Гей-Люсака)m = const, P = const: при незмінній масі і тискові об’єм газу прямо пропорційний температурі
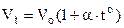 . (6.2)
. (6.2)
Тут Vo – об’єм газу при температурі 0оС, 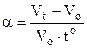 - температурний коефіцієнт об’ємного розширення. Він показує відносну зміну об’єму при зміні температури на 10. Вимірюється в 1/град, і для всіх ідеальних газів величина однакова і дорівнює 1/273 (1/град). Тому (6.2) набуває виду
- температурний коефіцієнт об’ємного розширення. Він показує відносну зміну об’єму при зміні температури на 10. Вимірюється в 1/град, і для всіх ідеальних газів величина однакова і дорівнює 1/273 (1/град). Тому (6.2) набуває виду
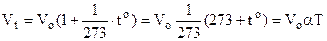 ,
,
де Т=273+to – температура по абсолютній шкалі (шкала Кельвіна). Графіки цього закону зображені на рис.6.3.
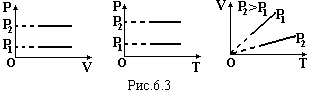
 |
Ізохорний процес (закон Шарля) m= const, V = const: при незмінній масі і об’ємові тиск газу прямо пропорційний температурі
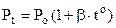 . (6.3)
. (6.3)
Тут Рo – об’єм газу при температурі 0оС, 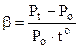 - температурний коефіцієнт тиску. Він показує відносну зміну тиску при зміні температури на 10. Вимірюється в 1/град, і для всіх ідеальних газів величина однакова і дорівнює 1/273 (1/град). Тому (6.3) набуває виду
- температурний коефіцієнт тиску. Він показує відносну зміну тиску при зміні температури на 10. Вимірюється в 1/град, і для всіх ідеальних газів величина однакова і дорівнює 1/273 (1/град). Тому (6.3) набуває виду
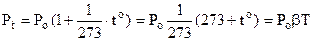 . (6.4)
. (6.4)
Графіки цього закону зображені на рис.6.4.
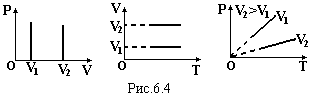
 |
Зв’язок між усіма чотирма параметрами дає рівняння стану ідеального газу – рівняння Клапейрона-Менделєєва:
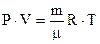 . (6.5)
. (6.5)
Тут μ – молярна маса газу, R = 8,31 Дж/(моль∙К) – газова стала.
Дата добавления: 2015-06-17; просмотров: 1202;
