Хімічний зв’язок між атомами – основа кристалічної структури мінералів.
Мінерал – хімічна сполука кристалічної будови.
Мінерали складаються із атомів, що закономірним чином, із проявом ближнього і дальнього порядку формують кристалічну структуру, утримуючись у рівноважному (стабільному) стані силами взаємного притягання і відштовхування.
Кристалічна структура – це результат зближення, зв'язування і закономірного розташування атомів один стосовно одного, що дає енергетичний виграш, порівняно із іншими комбінаціями, що можуть бути реалізовані в даних умовах. Формування кристалічної структури мінералів відбувається внаслідок взаємодії їх зовнішніх електронних оболонок таким чином, щоб урівноважити сили притягання та відштовхування.
Властивості мінералів разюче відрізняються від властивостей хімічних елементів, що їх утворюють. Порівняйте хімічні і фізичні властивості заліза і кисню, і згадайте властивості гематиту або ґетиту та попробуйте знайти спільні властивості вихідних речовин і мінералу, що утворився із них. Більше того, із одних і тих же речовин можна утворити зовсім різні мінерали із різними властивостями: графіт і діамант, пірит і піротин, і так дальше.
Для того, щоб зрозуміти природу виникнення такої різноманітності мінерального світу, ми повинні відповісти на запитання, вперше поставлені перед наукою видатним мінералогом та геохіміком В.М.Ґольдшмідтом і які можна перефразувати наступним чином:
ü Як кристалічна структура залежить від хімічного складу мінералу?
ü Яким чином фізичні властивості залежать від кристалохімічних особливостей кристалу?
Тоді ми не будемо лякатися строкатості мінерального світу, а побачимо його як закономірну систему, що дозволяє прогнозувати властивості невідомих мінералів за теоретично обрахованою структурою і визначати основні риси структури та хімічного складу мінералу за макроскопічними ознаками.
Першим фактором, що зумовлює особливості фізичних та хімічних властивостей мінералів, та зумовлює різноманітність мінералів є хімічний зв’язок між атомами елементів, що формують мінерал.
Вільна енергія мінералу менша від енергії атомів, що його складають, у вільному стані. Це є наслідком формування хімічного зв’язку між елементами.
Хімічні властивості атомів створюються електронами зовнішньої оболонки. Вони є рухливими,  найбільш здатними до переміщення і, в свою чергу, екранують електрони на внутрішніх оболонках від зовнішніх впливів.
найбільш здатними до переміщення і, в свою чергу, екранують електрони на внутрішніх оболонках від зовнішніх впливів.
Електронна конфігурація, що відповідає максимальному можливому (відповідно до заряду ядра) заповненню електронних оболонок, називається основним станом атома.
При активному енергетичному впливі оточення (теплові впливи, електромагнетне випромінювання і таке інше), електрон зовнішньої оболонки може перейти на рівень із вищою енергією – збудитися – в такому випадку ми отримаємо збуджену конфігурацію електронів, а сам атом буде знаходитися у збудженому стані.
 Розмір атома можна визначити за його місцем у періодичній таблиці хімічних елементів: зростання періоду (тобто зростання головного квантового числа) супроводжується збільшенням розміру атома. У межах періоду атоми, що розміщені по його краях мають більший розмір, ніж ті, що в середині ряду. Причиною цього є взаємодія сил притягання електронів до ядра, що росте із ростом ядра із силами взаємного відштовхування електронів, що заставляють їх переміщуватись на зовнішні орбіти.
Розмір атома можна визначити за його місцем у періодичній таблиці хімічних елементів: зростання періоду (тобто зростання головного квантового числа) супроводжується збільшенням розміру атома. У межах періоду атоми, що розміщені по його краях мають більший розмір, ніж ті, що в середині ряду. Причиною цього є взаємодія сил притягання електронів до ядра, що росте із ростом ядра із силами взаємного відштовхування електронів, що заставляють їх переміщуватись на зовнішні орбіти.
Коли електронів мало, вони мають високу кінетичну енергію і можуть без перешкодно рухатися , стараючись заповнити все доступне місце. Стійкою електронною конфігурацією є конфігурація із повним заповненням всіх підоболонок зовнішньої оболонки із розміщенням двох електронів із різними спінами на кожній орбіталі. Така конфігурація характерна для інертних газів (зокрема, аргону). Такі атоми не формують іонних чи ковалентних зв’язків із іншими атомами.
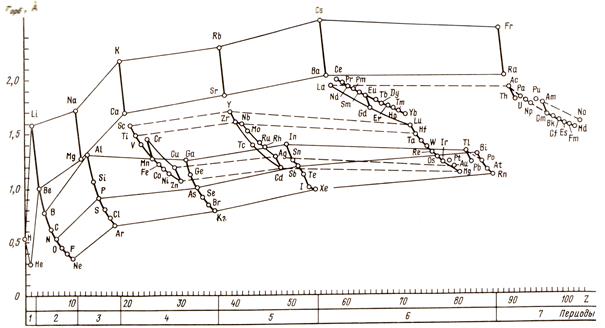
Рис. 4.1. Зміна орбітальних радіусів елементів залежно від атомного номера (Z).
Суцільними тонкими лініями зв’язані елементи Іа, ІІа-, ІІІа-, Va-, VIIIa-підгруп; тонкими штриховими лініями – елементи Ib-, IIb-, IIIb-, IVb-підгруп.
Не повністю заповнена зовнішня оболонка атома називається валентною оболонкою, а електрони, що знаходяться на ній називаються валентними; саме вони приймають участь у формуванні хімічного зв’язку. Здатність атома утворювати хімічні зв’язки називається його валентністю.
Очевидно, що чим ближче знаходиться валентний електрон до ядра атому, тим сильніші між ними електростатичні взаємодії. Тому оцінити силу зв’язку валентних електронів із ядром можна за радіусом атому чи іону у вільному стані. Квантова механіка дозволяє обчислити вірогідність знаходження електрону навколо атома, тобто електронну густину його орбіталі, як функцію перших трьох квантових чисел. Радіуси головних максимумів радіальної густини електронів зовнішніх орбіталей атомів називаються їх орбітальними радіусами (rорб).
Періодична зміна орбітальних радіусів атомів при зростанні атомного номера (рис. 4.1) відображає закономірну зміну електронної будови елементів. Ми бачимо, що найбільший орбітальний радіус властивий лужним металaм, а найменший – галогенам. Чим дальше знаходиться електрон від ядра, тим меншою є сила електростатичної взаємодії електрон–ядро і навпаки. Окрім цього, електростатична взаємодія електрон–ядро зменшується завдяки екрануванню ядра внутрішніми електронними оболонками. Саме ці чинники зумовлюють енергетичні характеристики атома, що визначають його здатність до формування хімічного зв’язку.

Рис. 4.2.. Зміна донорно-акцепторних (кислотно-основних) властивостей хімічних елементів залежно від їх спорідненості до електрону (F) і орбітального радіусу атомів (rорб) (за А.А.Годовиковим (1989)).
І – прості аніони; ІІ – прості і складні аніони; ІІІ – амфотерні катіони; ІІІа – благородні метали; ІV – лужні катіони; V - основи; VI – інертні гази.
Енергетичні характеристики атомів
Потенціал іонізації (I) – енергія, необхідна для відриву електрона від атома та віддалення на безмежно велику віддаль. Максимальний в інертних газів, мінімальний в лужних елементів. Це показник хімічної активності елементу.
Спорідненість до електрона (F) – енергія, необхідна для відриву електрона від стійкого від’ємного іона або енергія, яка виділяється внаслідок приєднання електрона до атома. Максимальна в галогенів.
Електронегативність
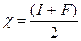
Мірою кулонівської взаємодії електрону, що відривається від атому, із ядром називається силовою характеристикою (СХ) атомів gорб та катіонів (gі). Ця енергетична характеристика співвідноситься із спорідненістю до електрону та потенціалом іонізації наступним чином:
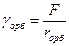

де In – n-й потенціал іонізації, ri – ефективний іонний радіус катіона із валентністю n+.
Співвідношення F та rорб(рис. 4.2) відображає характерні властивості хімічних елементів, що визначають їх здатність до формування певного типу хімічних, що видно на графіку.
Силові характеристики катіонів є мірою кислотно-лужних властивостей та здатності їх формувати прості солі чи комплексні аніони (рис. 5). Необхідно враховувати, що всі енергетичні характеристики повинні співвідноситися із валетним станом атому.

Рис. 4.3. Залежність між n-им потенціалом іонізації (In) і ефективним іонним радіусом (ri) для іонів
а – s- і p-елементів: І – сильні ангідриди, ІІ – слабкі ангідриди, ІІІ – амфотерні катіони, IV – основи, V – луги; б – d- і f- елементи: І – катіони в складі комплексних аніонів (як приклад, VO42-), ІІ – амфотерні катіони, ІІІ – основи.
Роль хімічного зв’язку у формуванні кристалічної структури мінералу
 Хімічний зв’язок – результат перерозподілу електронів, що веде до більш стабільної електронної конфігурації між двома або ж більше атомами.
Хімічний зв’язок – результат перерозподілу електронів, що веде до більш стабільної електронної конфігурації між двома або ж більше атомами.
Коли два або більше атомів наближаються достатньо близько один до одного , тоді електрони можуть перерозподілитися таким чином, щоб досягнути іншої конфігуративної енергії. Сумарна енергія атомів після формування зв’язку є меншою, ніж перед зв’язком.
Якщо результуюча, після перерозподілу електронів, конфігуративна енергія є меншою, то атоми залишаються в цій конфігурації разом і ми говоримо, що утворився зв’язок. При цьому форма оболонок та орбіталей стає іншою.
Перерозподілені електрони більше не зв’язані із окремим атомом, а є спільністю конфігурації атомів – це валентні електрони.
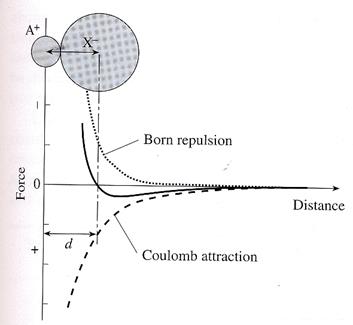
Рис. 4.4.. Зміна потенційної енергії атомів при їх наближенні.
Мінімум енергії, що виникає внаслідок накладення борнівського відштовхування між ядрами атомів і силою кулонівського притягання
Зв’язок формується шляхом збудження електронів у атомів, що вступають у зв’язок і утворення додатних та від’ємних зарядів. Таким чином формується сила (сила зв’язку), властива цьому зв’язку. Додатні заряди, що створюються протонами ядра, відштовхуються (борівське відштовхування) запобігаючи зіткненню ядер – це є точкові заряди (рис. 4.4). Електрони, що рухаються навколо них, електростатично притягуються до обох ядер, стабілізуючи конфігурацію групи. Чим більше електронів між ядрами (більша електронна густина), тим менше відштовхування, але існує критичне значення кількості електронів, вище якого зростає їх взаємне відштовхування.
Кожна пара унікальних хімічних елементів формує унікальний зв’язок. Дослідження останніх років показали, що зв’язок між атомами утворюється тільки тоді, коли існує критична точка (перегин кривої розподілу густини) (рис. 4.5) в електронній щільності між цією парою атомів.
Чим більше значення електронної густини в критичній точці, тим міцніший і коротший зв’язок. Міцні зв’язки короткі, слабкі зв’язки – довгі.
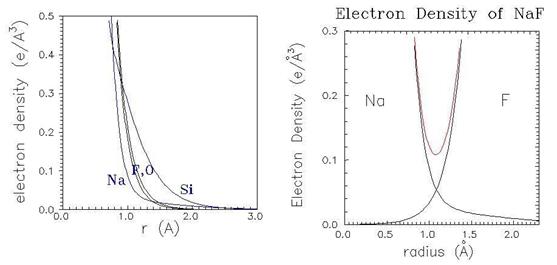
Рис. 4.5. Електронна густина в окремих атомів та їх асоціації
Розподіл електронної густини між атомами, що хімічно зв’язані, дозволяє визначити тип хімічного зв’язку між ними. Детальніше ця проблема розглядається в наступному розділі.
Дата добавления: 2015-05-21; просмотров: 1768;
