Металевий зв’язок
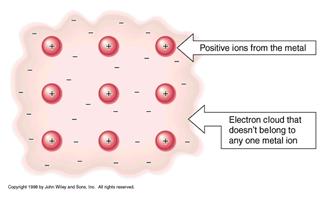 У тілах із металевим зв’язком всі атоми подібні, так як ці тіла характеризуються дифузною (розмазаною) електронною густиною, подібною до такої ж у катіонів у сполуках із іонним зв’язком.
У тілах із металевим зв’язком всі атоми подібні, так як ці тіла характеризуються дифузною (розмазаною) електронною густиною, подібною до такої ж у катіонів у сполуках із іонним зв’язком.
Рис. 4.6. Схема, що ілюструє металічний тип зв’язку
Валентні електрони є спільними для всіх атомів утворюючи «електронний газ» - позитивні іони у негативно зарядженому електронному газі. Поведінка електронного газу подібна до поведінки в’язкої смоли (клею), що склеює атоми.
 Атоми знаходяться в сферичній оболонці електронного газу, подібно до іонних сполук.
Атоми знаходяться в сферичній оболонці електронного газу, подібно до іонних сполук.
Порівняйте карти електронної густини для NaCl і міді.
Рис. 4.7. Карта електронної густини міді
Металевий зв’язок виникає в результаті перекривання орбіталей сусідніх атомів, у тому числі і при перекриванні незв’язаних орбіталей в кристалах із домінуючим іншим типом зв’язку. Необхідною умовою є низькі значення силових характеристик (СХ) атомів, що вступають у зв’язок. У чистому вигляді металевий зв’язок характерний для мінералів–самородних металів, перш за все s-елементів, а також f- і d- елементів; у р- елементів із високими СХ металевий зв’язок не виникає.
Дата добавления: 2015-05-21; просмотров: 1010;
