Електронегативність та ступінь іонності-ковалентності хімічного зв’язку
У природі не існує двох пар елементів, атоми яких формували б одинакові зв’язки. Кожний зв’язок є унікальним. Зв’язок Fe–O відрізняється від Ca–O, Mg–O, Si–O, не говорячи вже про C–H.
Іонний і ковалентний типи зв’язку є крайніми випадками серед великої різноманітності реально існуючих зв’язків; в більшості випадків хімічний зв’язок має проміжний поляризований (а не іонно-ковалентний) характер. Основна відмінність різних зв’язків проявляється в розподілі густин електронних хмар між атомами, що схематично показано на рис. 4.8.
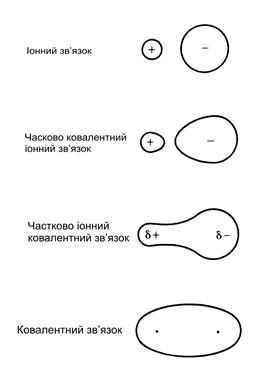
Рис. 4.8. Схема, що ілюструє зміну конфігурації електронних хмар при переході від іонного до ковалентного зв’язку.
Вибір іонного чи ковалентного типу зв’язку між двома елементами контролюється енергетичними характеристиками атомів, перш за все електронегативністю (c).
При різниці електронегативностей двох атомів атом із більшою електронегативністю здійснює електростатичний вплив на оточення, внаслідок чого в іншому атомі відбувається зміщення електронних оболонок, тобто проявляється поляризація зв’язку такої пари. Виникає електричний диполь із протилежними зарядами d+ і d-. Одна і та ж різниця c приведе до різної поляризації легких і тяжких атомів, що мають різну електронну будову.
Ковалентний зв’язок у чистому вигляді утворюється тільки між атомами із рівними електронегативностями, тобто за умови 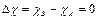 .
.
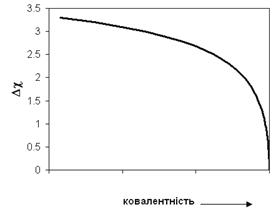
Рис. 4.9. Схема залежності міри ковалентності зв’язку від різниці електронегативностей атомів, що вступають у зв’язок.
У всіх інших випадках зв’язок носить проміжний, умовно будемо його називати іонно-ковалентний, характер. Оцінити іонність хімічного зв’язку в бінарній сполуці А і В можна за співвідношенням, запропонованим Полінгом:
частка іонного зв’язку 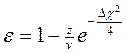 ,
,
де z –валентність атомів, v- координаційне число.
При оцінці зв’язку між двома атомами членом рівняння 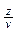 можна знехтувати.
можна знехтувати.
Таблиця 4.1. Електронегативність елементів за шкалою Полінга
(римськими цифрами показана валентність елементів)
| Элемент | ЕН | Элемент | ЕН | Элемент | ЕН | Элемент | ЕН |
| Н | 2,2 | V4+ | 1.7 | Sr | 1,0 | Те | 2,3 |
| Li | 1,0 | V5+ | 1.9 | Y | 1,2 | I | 2.6 |
| Be | 1,6 | Cr2+ | 1.5 | Zr4+ | 1.5 | Cs | 0,7 |
| В | 2.0 | Cr3+ | 1.6 | Nb | 1.6 | Ba | 0,9 |
| С | 2.6 | Mn2+ | 1.4 | Mo4+ | 1.7 | La | 1.1 |
| N | 3.0 | Mn3+ | 1.5 | Mo6+ | 2.3 | Lu | 1.2 |
| О | 3,1 | Mn4+ | 2,1 | Cd | 1,7 | Hf | 1,4 |
| F | 4.0 | Fe2+ | 1.8 | In | 1.8 | Та | 1.5 |
| Na | 0.9 | Fe3+ | 1.9 | Sn2+ | 1.8 | W4+ | 1.6 |
| Mg | 1.2 | Co2+ | 1.8 | Sn4+ | 2.0 | W6+ | 2.2 |
| Al | 1.6 | Ni2+ | 1,8 | Sb3+ | 1.9 | TI+ | 1,4 |
| Si | 1.9 | Cu+ | 1.8 | Sb5+ | 2.2 | TI3+ | 1.9 |
| P | 2.2 | Cu2+ | 2,0 | Os | 2,1 | Pb2+ | 1,8 |
| S | 2.6 | Zn | 1.6 | Ir | 2,1 | Pb4+ | 2,1 |
| Cl | 3,2 | Ga | 1,7 | Pt | 2,1 | Bi3+ | 2.0 |
| К | 0.8 | Ge | 2,0 | Rh | 2.1 | Bi4+ | 2,2 |
| Ca | 1.1 | As | 2,1 | Pd | 2,1 | U4+ | 1.4 |
| Sc | 1,3 | Se | 2,5 | Ag | 1,9 | U6+ | 1.9 |
| Ti4+ | 1.6 | Br | 3,0 | Au | 2,3 | ||
| V | 1.5 | Rb | 0,8 | Hg | 2,0 |
Останні дослідження концентруються на вивчення розподілу електронної густини навколо пари атомів, пов’язаних певним типом хімічного зв’язку.
Іонний зв’язок призводить до того, що один іон (катіон) має дифузну електронну хмару, а інший (аніон) – насичену, із різким градієнтом густини.
Ковалентні зв’язки утворюють високоградієнтну густу хмару між атомами, щільність якої різко зменшується назовні.
Дата добавления: 2015-05-21; просмотров: 2304;
