Гібридизація на прикладі сірки.
Зовнішні оболонки сірки містять два неспарених p-електрони і незаповнені 3d-орбіталі
| ¯ | ¯ | | | |||||
| 3s | 3p | 3d |
 Це дає можливість реалізації до 20 різних електронних гібридних структур зв’язку (за Полінгом) у сполуках сірки. У схемах гібридизації використовуються одна 3s- і три 3p-орбіталі – в такому випадку формується чотири пари неподілених і поділених електронних пар. У випадку залучення в гібридизацію однієї або декількох 3d-орбіталей кількість неподілених і поділених електронних пар зросте до дев’яти.
Це дає можливість реалізації до 20 різних електронних гібридних структур зв’язку (за Полінгом) у сполуках сірки. У схемах гібридизації використовуються одна 3s- і три 3p-орбіталі – в такому випадку формується чотири пари неподілених і поділених електронних пар. У випадку залучення в гібридизацію однієї або декількох 3d-орбіталей кількість неподілених і поділених електронних пар зросте до дев’яти.
Рис. 4.19. Електронні структури атомів сірки в ковалентних сполуках (за Полінгом)
ü Сірка із «нормальною» валентністю 2 має електронну структуру зображену на рис. 4.19 під номером 3; її дві гібридні орбіталі, орієнтовані під кутом 92-108°, на 93% складені 3p-орбіталями і на 7% 3s-орбіталями. Така схема гібридизації реалізована в реальгарі As4S4, аурипігменті As2S3, кіноварі HgS.
ü При використанні однієї неподіленої пари, як акцептора електронів формується трьохковалентна сірка (номер 2 на рис. 4.19) із трьома зв’язками із атомами молібдену в шаруватій структурі молібденіту MoS2.
ü Чотирьохковалентна сірка (номер 1 на рис. 4.19) утворює структури сульфідів цинку (сфалериту і вюртциту), халькопіриту.
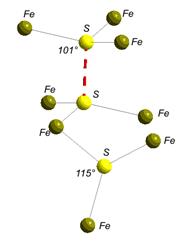
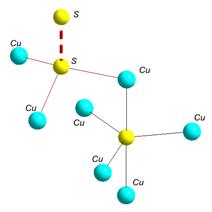
ü Дисульфідна сірка (номер 5 на рис. 4.19) здатна формувати подвійні зв’язки між собою. Конфігурація зв’язків може дещо змінюватися (порівняйте конфігурацію такої сірки у піриті FeS2 та ковеліні CuS (рис. 4.20); вони відрізняються кутами між зв’язками).
ü У ковеліну присутня також сірка у п’ятиковалентному стані (номер 6 на рис. 4.19) із зв’язками, направленими до кутів тригональної біпіраміди, які варто очікувати для S+ із dsp3-гібридизацією (рис. 4.20).
| 
|
Рис. 4.20. Конфігурація зв’язків сірки в структурі піриту (ліворуч) і ковеліну (праворуч).
Мінерали із sp<SPAN STYLE="font-size: 10pt">3</SPAN>-гібридизацією та тетраедричною координацією катіонів
Халькопірит станін Cu2FeSnS4 алабандит MnS
Мінерали із d<SPAN STYLE="font-size: 10pt">2</SPAN>sp<SPAN STYLE="font-size: 10pt">3</SPAN>-гібридизацією та октаедричною координацією катіонів: сульфіди Fe, Ni, Pt; як аніони - найбільш типові гантельні аніони типу S22-,(AsS)3- ,As24- , що мають по шість зовнішніх електронних пар.
Поряд із цим відомі октаедричні ковалентні сполуки, в яких аніони мають не по шість а по чотири пари зовнішніх аніонів. Це можуть бути аніони типу S22-, As22-. В подібних сполуках ті електронні пари, котрих не вистачає для заповнення вакантних d<SPAN STYLE="font-size: 10pt">2</SPAN>sp<SPAN STYLE="font-size: 10pt">3</SPAN>-гібридизованих орбіталей катіонів, отримуються за рахунок зближення катіонів між собою та їх безпосереднього обміну електронами, тобто появою металічної компоненти зв'язку. Це характерно для троіліту, нікеліну, льолінгіту та їх аналогів.
Зв'язок в ковалентних кристалах звичайно є поляризованим.
Зростання поляризованості зв'язку знижує міцність ковалентних сполук.
Дата добавления: 2015-05-21; просмотров: 1086;
