Координаційні (донорно-акцепторні) зв’язки і комплексні радикали в мінералах
Оскільки перебування електронної пари із антипаралельними спінами в межах однієї молекулярної орбіталі енергетично є більш вигідне, ніж в атомній орбіталі одного із атомів, ковалентний зв’язок може також утворюватися в результаті передачі одним атомом (донором) своєї неподільної пари іншому атому із вільною (незаповненою) орбіталлю (акцептору). Такий тип ковалентного зв’язку характерний для великої кількості координаційних (комплексних) сполук. Донорами в цьому випадку є іони лігандів, а акцепторами – метали-комплексоутворювачі. Зв’язок, що виникає при цьому, називається донорно-акцепторним або координаційним. В комплексних іонах лігандами є аніони S2-, O<SPAN STYLE="font-size: 9pt">2</SPAN>, F-, Cl-; іонами-комплексоутворювачами – елементи, здатні в парі із лігандом утворювати донорно-акцепторний зв'язок –Fe, Mn, Co, Ni та інші. Такий зв’язок є в численних мінералах оксисолях (різноманітні карбонати, фосфати, сульфати, силікати) та сульфосолях.
Розглядаючи комплексні сполуки, варто звернути увагу на можливість реалізації різних схем формування зв’язку. Це можна пояснити на прикладі утворення комплексу [Co(NH3)6]3+. Катіон Co3+ із 3d6-електронами має наступним чином заповнені d-орбіталі
| ¯ | | | | |
Такий катіон, через свій високий спіновий момент, називається високоспіновим і позначається як  . Але енергетичний виграш, зумовлений можливістю формування нових ковалентних зв’язків спричинює зпарення 3d6-електронів із вивільненням двох d-орбіталей. Виникає низькоспіновий катіон
. Але енергетичний виграш, зумовлений можливістю формування нових ковалентних зв’язків спричинює зпарення 3d6-електронів із вивільненням двох d-орбіталей. Виникає низькоспіновий катіон 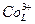 із сумарним спіновим моментом, рівним нулю
із сумарним спіновим моментом, рівним нулю
| ¯ | ¯ | ¯ |
Високо-спіновий катіон є парамагнетним, а низько спіновий – діамагнетним. Дві вивільнені 3d -орбіталі гібридизуються із однією 4s- і трьома 4p-орбіталями, утворюючи шість пустих d2sp3-гібридних орбіталей, кожна як акцептор, може прийняти по одній електронній парі від донора NH3 із формуванням донорно-акцепторного ковалентного зв’язку. Центральний катіон 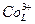 буде мати октаедричну координацію.
буде мати октаедричну координацію.
Будова аніонних оксикомплексів визначається типом гібридизації електронних орбіталей комплексоутворювача. Серед s- і p-елементів (Be, B, C, Al, Si, P, S, As, Sb) переважає sp2- і sp3-гібридизація, що зумовлює тетраедричну (Be, B, P, S, Si, Al) або тригональну (B, C) координацію в оксисолях.
Серед d-елементів тільки високо спінові катіони Cr, Mo, W здатні формувати тетраедричні аніонні радикали із лігандами кисню. Такі катіони як Ti4+ , Zr4+, V5+ утворюють слабкі аніонні радикали зумовлені проявом у них d<SPAN STYLE="font-size: 8pt">5</SPAN>s-гібрідизації.
Сульфосольні комплексні радикали [XS3]3- і [XS4]4-, в яких Х=As3+, Sb3+, Bi3+, As5+, Sb5+, утворюють сполуки із одно- і двох-валентними катіонами Cu+, Ag+, Pb2+, Hg2+ та іншими. Катіони–комплексоутворювачі мають наступні схеми гібридизації:
1. p3 (трикутна піраміда «парасолька» As3+, Sb3+, Bi3+)
2. sp3 (тетраедр As5+, Sb5+).
В одноядерних аніонних комплексах тільки частина подвійного від'ємного заряду задовольняється комплексоутворювачем, решта йде на утворення іонного зв'язку із катіонами.
Інший варіант - полімеризація, утворення поліядерних комплексів, коли ліганди </SPAN>одного комплексу стають спільними для сусідніх двох. Класичним прикладом полімеризації є формування складних кремнекисневих радикалів із одно ядерного комплексу [SiO4]4-. Два сусідні кремнекисневі радикали усуспільнюють один ліганд O<SPAN STYLE="font-size: 9pt">2-, утворюючи кисневий мостик.
[SiO4]4- à [Si2O7]6-
Поліконденсація може продовжуватись аж до формування трьохмірних каркасів SiO2 із нульовим зарядом. Включення в каркас тетраедрів [AlO4]3+ веде до формування зарядженого каркасу [Al<SPAN STYLE="font-size: 8pt">m</SPAN>Si<SPAN STYLE="font-size: 8pt">n</SPAN>O<SPAN STYLE="font-size: 8pt">2(m+n)</SPAN>]<SPAN STYLE="font-size: 8pt">m-</SPAN>.
Поліядерні полімерні комплекси можуть утворюватись із трикутників [BO3] та тетраедрів [BO4] у боратів та боросилікатів та із радикалів [(As,Sb)S3]3- і [(As,Sb)S4]4- у сульфосолей.
Дата добавления: 2015-05-21; просмотров: 1033;
