Дисперсійний зв’язок
 Рис. 4.28. Дисперсійні зв’язки між спіральними молекулами у структурі самородного селену
Рис. 4.28. Дисперсійні зв’язки між спіральними молекулами у структурі самородного селену
Сили притягання дисперсійного типу (лондоновські сили) виникають внаслідок миттєвих флуктуацій (самовільних змін, варіацій, коливань) електронної густини молекулярних орбіталей. В результаті таких флуктуацій електронні хмари втрачають симетричність і на молекулі виникає миттєвий диполь, що індукує диполь в сусідній молекулі. Такі взаємодії дуже слабкі і при збільшенні температури втрачають своє значення. Саме вони формують кристалічну структуру при кристалізації благородних газів.
Найщільніша упаковка і координаційний принцип
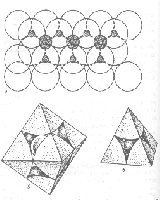
|
| Рис. 4.29. |
Взаємне розміщення атомів в кристалічній структурі контролюється двома факторами:
· Типом найщільнішої упаковки
· Координаційним принципом
Атоми/іони в структурі мінералу можуть бути розміщені щільно, або є ні, тобто структура може відповідати принципу найщільнішої упаковки, або ж в певній мірі відхилятись від нього.
Як вам відомо, існує два способи вкладання куль одинакового розміру:
1. двошаровий (за характером сингонії – гексагональний) A-B-A-B-…
2. трьохшаровий (кубічний) – A-B-C-A-B-C-…..
Можливі варіанти та комбінації обох цих типів.
Щільно укладені кулі займають лише 74% об’єму структури, решта 26% - це пустоти – інтерстиції – між кулями.
За характером оточення виділяються два типи пустот:
1. тетраедричні – менші за розміром, обмежені чотирма кулями
2. октаедричні – більші за розміром, обмежені шістьома кулями
В безмежній кристалічній структурі із найщільнішою упаковкою на n куль приходиться 2n тетраедричних і n октаедричних пустот.
Кількість мінералів із ідеальною найщільнішою упаковкою є невеликою і зустрічається серед мінералів із металічним та іонним типами зв’язку. Тільки деякі мінерали із ковалентним типом зв’язку (сірка, алмаз) та із змішаними типами зв’язку (олівін, гранат) наближаються до найщільніших упаковок. Такі мінерали характеризуються високою густиною (із врахуванням атомної ваги атомів, що складають ці мінерали). Більшість мінералів характеризується складною будовою структури, в якій принцип найщільнішої упаковки реалізується тільки в межах певних блоків.
Координаційний принцип
У щільно упакованій структурі, що складається із атомів однакового розміру, кожний атом оточений 12 сусідами.
Характер упаковки атомів в кристалічній структурі залежить від типу хімічного зв’язку та від співвідношень радіусів атомів та іонів, що складають структуру.
Металічний та іонний зв’язки є ненаправленими і тип упаковки та координаційні числа атомів та іонів визначаються їх співвідношеннями радіусів атомів та іонів різного сорту за єдиним принципом. Як приклад для розгляду, візьмемо мінерали із іонним типом зв’язку.
Іонний зв'язок не має просторової скерованості. Утворення структури речовини із ненаправленим іонним зв'язком підпорядковується принципу найщільнішої упаковки найбільш крупних іонів В структури. Дрібні іони А заповнюють тетраедричні чи октаедричні пустоти між ними.
Характер пустот і відповідно, координація іонів у пустотах визначається співвідношенням іонних радіусів rA/rB (правило Магнуса).
| rA/rB | КЧ | ||||
| 0.225 | 0.415 | 
| |||
| 0.415 | 0.732 | 
| |||
| 0.732 | 1.000 | 
| |||
| 1.000 | |||||
Взагалі ж в кристалічній структурі мінералу встановлюються різні координаційні числа: 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12.
Координація атому в структурі та тип його зв’язку із сусідами визначається власною будовою атома.
Координаційна сфера першого, другого та вищих порядків
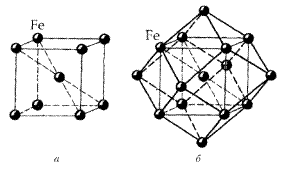
Рис. Кристалічна структура α-Fe
В першій координаційній сфері об’ємно-центрованої структури самородного заліза 8 атомів; у другій – 6. Відповідно друга координаційна сфера охоплює 8+6=14 атомів.
Координаційні поліедри – куб і ромбододекаедр.
Дата добавления: 2015-05-21; просмотров: 997;
