Молекулярні (залишкові) зв’язки
Відомо багато мінералів, що складаються із окремих молекул. Їх ще називають молекулярними кристалами. В таких кристалічних тілах атоми в межах молекул зв’язуються між собою міцними ковалентними зв’язками, тоді як самі молекули втримуються в кристасталічній структурі залишковими (молекулярними)силами, що «залишаються» від ковалентного зв’язку в межах молекул. Вони значно слабші внутрішньо молекулярних сил.
Молекулярні зв’язки мають різну природу. Атоми в структурі не мають чітких границь. Тому валентні електрони в молекулі не завжди знаходяться в межах, що визначаються напрямком хімічного зв'язку, а можуть існувати інші місця менш вірогідного але все таки можливого їх перебування. В такому випадку молекули можуть взаємодіяти між собою.
Водневі зв’язки
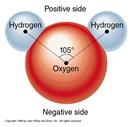 Водневі зв’язки є поширеними в мінералах, що містять молекули H2O або групи ОН. Так як атом кисню є більш електронегативний, порівняно із атомами водню, це зумовлює поляризацію молекули води або груп ОН. Виникаю диполь, в якому невеликий від’ємний заряд відповідає атому кисню, а додатній – атому водню. Цей додатній заряд атома водню притягується до неподіленої електронної пари на сусідньому атомі кисню. Ця електростатична взаємодія між атомами водню груп ОН і кисню інших груп називається водневим зв’язком. Такий же зв’язок водню може утворюватися не тільки із киснем, але і з іншими атомами із високою електронегативністю – F, Cl, N, B, S.
Водневі зв’язки є поширеними в мінералах, що містять молекули H2O або групи ОН. Так як атом кисню є більш електронегативний, порівняно із атомами водню, це зумовлює поляризацію молекули води або груп ОН. Виникаю диполь, в якому невеликий від’ємний заряд відповідає атому кисню, а додатній – атому водню. Цей додатній заряд атома водню притягується до неподіленої електронної пари на сусідньому атомі кисню. Ця електростатична взаємодія між атомами водню груп ОН і кисню інших груп називається водневим зв’язком. Такий же зв’язок водню може утворюватися не тільки із киснем, але і з іншими атомами із високою електронегативністю – F, Cl, N, B, S.
Віддаль між ядрами водню і кисню при водневому зв’язку переважно коливається від 0,96 до 1,2Å, що є менше ніж ефективний іонний радіус O2-, тобто фактично іон Н+ знаходиться всередині електронної хмари іону кисню. Атом водню може розміщуватися на однаковій віддалі від обох атомів кисню (симетричний зв’язок, як у ґетиту на рис. 4.26) або ж зміщуватися до одного із них (асиметричний зв’язок у серпентинів на рис. 4.23). Довжина зв’язку короткого плеча О-Н коливається від 0,96–1,07Å, довгого – до 1,8 Å в асиметричному зв’язку, до 1,2 Å – у симетричному зв’язку. Симетричний зв’язок є сильніший порівняно із асиметричним.
Своєрідність водневого зв’язку, зокрема асиметричність, зумовлюють специфіку термічної дисоціації мінералів із групами ОН. При температурах вище 100°С ці сполуки виділяють воду (так звана „кристалізаційна вода”, хоча в структурі цих мінералів молекул води не існує).
| 
|
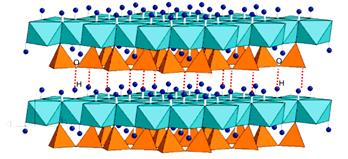
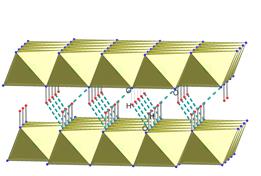
| Рис. 4.23. Водневі зв’язки у серпентинів Mg3(OH)4[Si2O5]. | Рис. 4.24. Водневі зв’язки, що зв’язують молекули-шари в структурі бруситу Mg(OH)2. Водневий зв’язок показано переривчастою лінією. |
Ці зв’язки відіграють важливу роль у формуванні твердих тіл – льоду, гіпсу, бруситу Mg(OH)2, каолініту Al2(OH)4[Si2O5], діаспору AlOOH.
У структурі бруситу (рис. 4.24) нуль-зарядні шари зв’язуються між собою водневими зв’язками.
В мінералах із групами ОН водневі зв’язки в структурі можуть сприяти стабілізації певної конфігурації структури. Саме таку роль відіграє водневий зв’язок у формуванні каркасної структури метабориту HBO2, ґетиту FeOOH та діаспору AlOOH.

| 
|
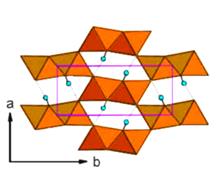
| Рис. 4.25. Водневі зв’язки в структурі метабориту B(OH)4 | Рис. 4.26. Водневі зв’язки у структурі ґетиту. |
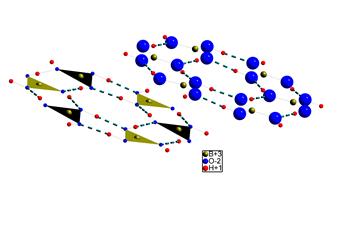
| Рис. 4.27. Водневі зв’язки в структурі сасоліну B(OH)3 У структурі сасоліну водневі зв’язки з’єднують молекули B(OH)3 в кільця, а кільця, у свою чергу, в’яжуться в шари. На рисунку показані два паралельних кільця, в яких по різному показано структуру – в поліедричному виді (нижнє кільце) і в кульковому (верхнє). |
Вандерваальсівські зв’язки
Слабші від водневого молекулярні зв’язки звичайно об’єднуються під загальною назвою – вандерваальсівські зв’язки. Всі вони базуються на диполь-дипольній взаємодії і відрізняються тільки природою виникнення диполів.
Вандерваальсівські зв’язки в мінералах
Молекули в мінералах із молекулярною структурою можуть бути простими, такими як кільця сірки, кулясті молекули реальгару As4S4 (рис. ), арсеноліту As4O6, сенармонтиту Sb4O6 , або ж багатоатомними полімерними типу ланцюжків (кіновар, антимоніт, вісмутин), простин чи багатолистих шарів (аурипігмент, молібденіт, телуробісмутит, тетрадиміт, тальк).
Дата добавления: 2015-05-21; просмотров: 1506;
