Тип зв’язку та найщільніша упаковка
Ковалентний зв'язок направлений. Структура будується не за принципом найщільнішої упаковки, а з метою найбільшого забезпечення направлених зв'язків.</SPAN>
<SPAN STYLE="font-family: Times New Roman"></SPAN>Атоми, що можуть створити тільки по одному зв'язку можуть утворювати тільки двоатомні молекули. багатоатомних молекул із ковалентним зв'язком вони створити не можуть.
В випадку, якщо атоми можуть створювати два або три зв'язки можуть утворюватись багатоатомні ланцюжкові, кільцеві, тетраедричні молекули, двійні гофровані шари.
Заразом, всі подібні молекули не можуть утворювати неперервної кристалічної гомодесмічної структури. Навіть ланцюжкові та шаруваті молекули, що можуть містити будь-яку кількість атомів, залишаються лише молекулами. Для утворення із них кристалічної структури необхідно пов'язати їх між собою, що і відбувається за рахунок зв'язків іншої природи - залишкових.
Кристалічна структура із чисто ковалентними зв'язками виникає тільки в випадку коли кожний атом може утворювати як мінімум чотири ковалентних зв’язки. Прикладом може слугувати структура алмазу - молекула із великої кількості атомів C.
Чим більш міцніший зв’язок тим менше КЧ
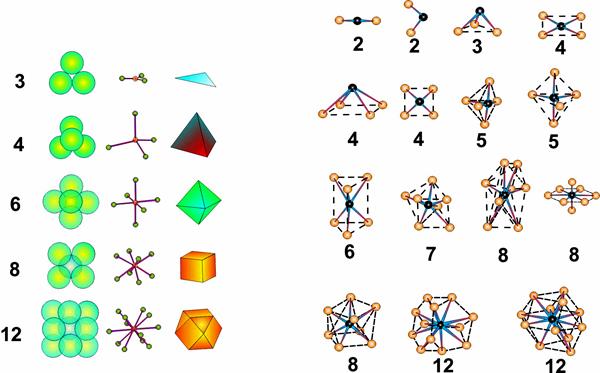
Рис. 4.30. Координаційне число і гібридизація зв’язків
Таблиця 4.3. Типи гібридизації та просторової конфігурації зв'язків
| Кількість зв'язків | Тип гібридизації | Просторова конфігурація зв'язків | Приклади |
| s | |||
| sp | Лінійна<SPAN STYLE="font-family: Times New Roman"></SPAN> | Hg-S в кіноварі, S-S в сірки | |
| p3 | Взаємно перпендикулярна | Pb-S в галеніту | |
| sp2 | Трикутна плоска<SPAN STYLE="font-family: Times New Roman"></SPAN> | С-С в графіту; | |
| sp3 | Тетраедрична | Zn - сфалериту | |
| sf3 | Тетраедрична | ||
| dsp2 | Квадратна плоска | Cu в азуриті | |
| d2sp3 | Октаедрична | Sn в каситериту | |
| d2sf3 | Октаедрична | ||
| d4sp | Тригонально-призматична | Mo - молібденіту |
Координаційне число катіонів у ковалентних сполуках визначається типом гібридизації валентних орбіталей. Координаційне число аніонів визначається відповідністю між числом їх зовнішніх електронних пар і числом акцепторних орбіталей катіонів, що приймають ці пари.
Структура мінералу – це компроміс між можливістю реалізації найщільнішої упаковки із атомів/іонів певних розмірів і взаємного просторового розміщення атомів. що задається типом зв’язку.
Кристалічна структура ковалентних кристалів виникає як результат донорно-акцепторної відповідності кількості вакантних орбіталей катіону і електронних пар аніону.
Необхідно пам’ятати, що атоми є рухливими і не міцно прив’язані до одного місця, а здійснюють коливання навколо певного місця, в якому найбільш вірогідно їх зустріти. Такі коливання називаються тепловими і зростають із ростом температури.
Із ростом температури міцність зв’язків знижується. Спочатку руйнуються залишкові, потім іонні, а потім ковалентні зв’язки.
Іонний зв'язок
Іонна структура визначається
Ø типом найщільнішої упаковки;
Ø типом та заселеністю порожнин;
Ø законом (мотивом, взором), за яким відбувається відбір між заселеними та незаселеними пустотами, якщо не всі пустоти даного типу не заселені.
Утворення кристалічних фаз підпорядковується правилу електронейтральності.
При великих тисках більшість елементів утворює сполуки із металічним зв’язком.
Таблиця 4.4. Залежність властивостей мінералів від типу хімічного зв'язку
| Тип зв'язку | Твердість | Ковкість, крихкість | Прозорість | Світлозаломлення | Електропровідність |
| Іонний | Різна | Крихкі | Прозорі | Середнє, низьке | Діелектрики |
| Ковалентний | Різна, часто висока | Крихкі і ковкі | Прозорі, частково прозорі | Високе | Діелектрики, напівпровідники |
| Металічний | Середня | Висока ковкість | Непрозорі | Висока відбивна здатність | Провідники |
| Молекулярний | Низька | Крихкі | Прозорі | Частіше низьке | Ізолятори |
Дата добавления: 2015-05-21; просмотров: 1369;
