Делокалізові орбіталі та резонанс зв’язків
Ковалентні зв’язки є орієнтованими із постійними кутами між собою. Вони завжди займають певне місце у молекулі чи кристалі, тому відповідні зв’язуючі орбіталі називаються локалізованими. Поряд із ними можуть існувати зв’язки, для яких неможливо вказати точне розміщення (локалізацію) зв’язуючих орбіталей. Делокалізація зв’язуючих орбіталей виникає у випадку наявності декількох енергетично рівнозначних варіантів її встановлення. Делокалізованими є переважно p-зв’язки, для яких можлива варіативність в періодичній структурі мінералу. Часто важко описати електронну валентну структуру сполуки тільки одним способом: існує два або більше варіантів такої структури. У такому випадку говорять, що має місце резонанс між можливими конфігураціями в межах одного типу молекули чи сполуки. Для прикладу: якщо атом має в оточені шість сусідів і можливість встановити тільки один p- зв’язок із любим із них, то орбіталь резонує між шістьома позиціями, між шістьома електронними структурами.
Для прикладу, резонансними є зв’язки у багатьох сполук із вуглецем

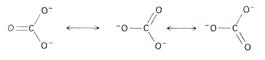
Явище резонансу зв’язків підтверджується замірами віддалей між атомами. Відомо, що віддаль між атомами зв’язаними подвійним зв’язком на 0,21Å менша, ніж у випадку одинарного зв’язку. Відстань між двома атомами вуглецю із одинарним зв’язком (наприклад, в діаманту) є 1,54 Å, а при подвійному зв’язку – 1,33 Å. Для комбінації С–О відстань рівна 1.22 Å, але в молекулі СО2, яку звичайно зображають як О=С=О ця віддаль складає 1,16. Таке зменшення віддалі зумовлено наявністю певної частки потрійного зв’язку, як показано вище.

|  
|

| 
|
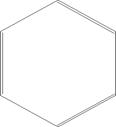
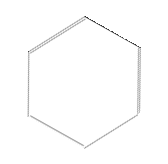
Рис. 4.21. Формування делокалізованих зв'язуючих орбіталей у графіту
Делокалізовані орбіталі є визначальними у формуванні властивостей графіту. У структурі графіту, як було сказано вище, внаслідок sp2- гібридизації виникають зв’язуючі d-орбіталі та утворюється мережа гексагональних кілець із атомів вуглецю (рис. 23а). Не гібридизовані р-орбіталі попарно зв’язуються p-зв’язками (рис. 23б). Існує два варіанти такого поєднання (рис. 23в), що реалізуються випадково, стохастично; відповідно, електрони, що формують такий p-зв’язок стають нелокалізованими, а відповідні молекулярні орбіталі „розмазуються” по всій мережі (обох сторонах шару) (рис. 23г). Електрони на таких орбіта лях можуть легко переміщуватися від одного атома до другого, що зумовлює чудову тепло- і електропровідність графіту.
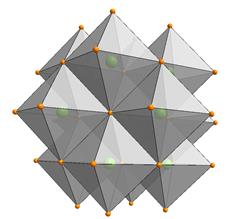
Резонансні зв’язки поширені в сульфідах повновалентних катіонів, таких як Pb2+, Sb3+, As3+, Bi3+. Так в галеніті Pb2+ має три валентних p-орбіталі, а 6s-орбіталь екранується 5d та 5f-орбіталями. В такій ситуації можлива тільки p3-гібридизація, причому три гібридизовані зв’язуючі орбіталі резонують між шістьома однозначними позиціями. Це приводить до формування реального зв’язку із 3+3 атомами сірки і делокалізації зв’язуючих орбіталей навколо атомів свинцю, а відповідно, появі складової металічного зв’язку в кристалічній структурі. Аналогічно, за резонансною схемою, формується шестерна координація трьох ковалентної сірки в галеніті. Наслідком резонансної координації і делокалізації зв’язуючих орбіталей галеніту властиві металічний блиск і напівпровідникові властивості.
| 
|
Рис. 4.22. Структура галеніту як результат резонансу гібридизованих p3-орбіталей.
Завершуючи розгляд місця ковалентного типу зв’язку у формуванні кристалічної структури мінералів необхідно відмітити наступне:
- На відміну від іонного зв’язку, ковалентний зв’язок направлений і тому перехід від ковалентного до іонного типу зв’язку є стрибкоподібним.
- Так звана частка іонності ковалентного зв’язку зумовлена, в першу чергу, появою ефективного заряду в поляризованих ковалентних групах.
- Наявність делокалізованих зв’язуючих орбіталей може призводити до появи іонної та металічної складових зв’язку в ковалентних сполуках.
- Металічна складова зв’язку у ковалентних сполуках виникає за рахунок наближення атомів і перекриття їх неподілених орбіталей.
- Зростання поляризованості та металічності зв'язку понижує міцність ковалентних сполук.
Дата добавления: 2015-05-21; просмотров: 865;
