Гібридизація орбіталей у ковалентних сполуках
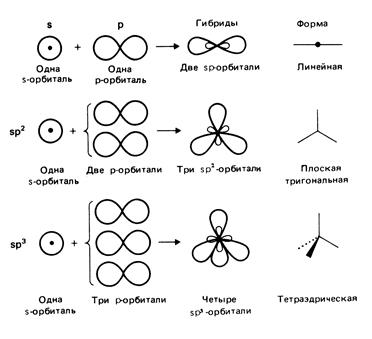
У багатьох ковалентних сполуках атомні орбіталі, що приймають участь у формуванні зв’язків, змішуються таким чином, що утворюються нові орбіталі із іншою просторовою конфігурацією і проміжними енергетичними характеристиками (рис. 4.17). При цьому гібридні орбіталі виразно асиметричні і утворюють стабільну конфігурацію із певним кутом між собою. При формуванні зв’язку гібридні орбіталі розщеплюються на зв’язуючу і антизв’язуючу, як показано на рис. 4.16.
|  Рис. 4.17. Орієнтованість гібридизованих зв’язків.
Рис. 4.17. Орієнтованість гібридизованих зв’язків.
|
Так, змішування однієї s-орбіталі із однією p-орбіталлю утворюються дві sp-орбіталі, а із двома p-орбіталями – три sp2-орбіталі. Конфігурація із трьох гібридних sp3- орбіталейформується із s-орбіталі і трьох p-орбіталей.
Гібридизаціяописується правилом Р. Гілеспі: електронні пари розміщуються на валентній оболонці атома таким чином, щоб бути максимально віддаленими одна від другої, тобто електронні пари взаємно відштовхуються.
Асоціації атомів (молекули чи в складі кристалічного тіла, для прикладу), що виникають при зв’язуванні гібридних орбіталей, мають цілком певну конфігурацію, що контролюється типом гібридизації.
Вірогідність гібридизації визначається, перш за все, наступними факторами::
Ø Енергетичною близькістю орбіталей, що гібридизуються; в межах періоду таблиці Мендєлєєва вірогідність sp-гібридизації зменшується із збільшенням атомного номера.
Ø Енергетичним ефектом утворення зв'язків, що виникають внаслідок гібридизації; цей ефект пропорціональний силовим характеристикам атомів і тому зростає із збільшенням атомного номера в межах періоду і в групі.
Можливість гібридизації визначається співвідношенням кожного із цих факторів.
Один атом може мати декілька вірогідних схем гібридизації, що створює можливість варіацій кристалічних структур, що формуються із їх участю.
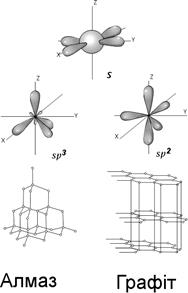
| Гібридизація на прикладі вуглецю. Рис. 4.18. Кожний атом вуглецю використовує для зв'язку не тільки свої валентні 2p<SPAN STYLE="font-size: 10pt">2</SPAN>-електрони, але і свої валентні 2s<SPAN STYLE="font-size: 10pt">2</SPAN>-електрони. Причиною цього є гібрідизація s- і p-валентних орбіталей, утворення за їх рахунок гібридних орбіталей із проміжними енергетичними характеристиками. Гібридні орбіталі різко асиметричні і мають певний кут відносно одна одної. В алмазі sp3- гібридизація, одинакова сила та розмір всіх зв’язків і як наслідок, однорідна структура. В структурі всі чотири зв'язки еквівалентні, тобто в алмазу немає відмінностей між s і p- валентними електронами, між s і p-валентними орбіталями. В графіту sp2- гібрідизація; sp2-орбіталі розмішені в одній площині під кутом 120° між собою. Лише три із чотирьох валентних електронів утворюють ковалентний зв’язок, а четвертий електрон не локалізований, викличає появу частково металічного зв’язку і електропровідності. Існує ще одна кристалічна форма вуглецю - чаоіт (карбін) (в метеоритах та астроблемах), у якої зв’язок між атомами вуглецю має лінійну форму (вуглець двовалентний, гібридизації немає) |
Дата добавления: 2015-05-21; просмотров: 1779;
