Віддалі між атомами у кристалічній структурі
Вище ми згадували орбітальні атомні радіуси. Якщо електрон при формуванні зв’язку збуджується, то він переміщується або стосовно свого ядра, або ж переходячи в оболонку іншого атома. Таким чином атом стає іоном і його радіус змінюється – у катіонів він різко зменшується, у аніону – зростає.
Радіуси іонів у кристалах відрізняються від орбітальних радіусів вільних атомів. Перша система іонних радіусів, розроблена В.М.Гольдшмідтом і її сучасний варіант приведено в табл. 4.2).
Таблиця 4.2. Іонні радіуси елементів.
| Елемент | ri | Елемент | ri иця 2.3. Іонні радіуси елементів.
| Елемент | ri | Елемент | ri | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Н | 0.79 | V | 1.92 | Тс | 1.95 | Re | 1.97 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Li | 2.05 | Cr | 1.85 | Ru | 1.89 | Os | 1.92 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Be | 1.40 | Mn | 1.79 | Rh | 1.83 | Ir | 1.87 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| В | 1.17 | Fe | 1.72 | Pd | 1.79 | Pt | 1.83 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| С | 0.91 | Co | 1.67 | Ag | 1.75 | Au | 1.79 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N | 0.75 | Ni | 1.62 | Cd | 1.71 | Hg | 1.76 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O | 0.65 | Cu | 1.57 | In | 2.00 | ТІ | 2.08 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| F | 0.57 | Zn | 1.53 | Sn | 1.72 | Pb | 1.81 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Na | 2.23 | Ga | 1.81 | Sb | 1.53 | Bi | 1.63 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mg | 1.72 | Ge | 1.52 | Те | 1.42 | Po | 1.53 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Al | 1.50 | As | 1.33 | I | 1.32 | At | 1.43 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Si | 1.46 | Se | 1.22 | Cs | 3.34 | OH- | 1.32 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| P | 1.23 | Br | 1.12 | Ba | 2.78 | Ra | 1.48 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S | 1.09 | Rb | 2.98 | La | 2.74 | Ac | 1.12 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cl | 0.97 | Sr | 2.45 | Hf | 2.16 | U | 1.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| К | 2.77 | Y | 2.27 | Та | 2.09 | Ті | 0.74 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ca | 2.23 | Zr | 2.16 | W | 2.02 | Mo | 0.69 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sc | 2.09 | Nb | 2.08 |
Розміри атомів, що знаходяться в ковалентному зв’язку, є дещо іншими і тому можна використовувати поняття ковалентного радіусу.
Фактори, що впливають на віддалі між атомами
o викривлення координаційних поліедрів
o часткове заселення катіонних позицій
o ковалентність та металевість зв’язків
Визначення типу зв’язку за міжатомною віддаллю
Міжіонне відштовхування. Важко наблизити два іони, віддаль між ними близька до суми їх іонних радіусів.
Якщо міжатомна віддаль менша від суми можливих в цій координації іонних радіусів, то зв’язок наближається до ковалентного. Міжатомна віддаль пропорційно зменшується із ростом ковалентності зв’язку. Це явище називається ковалентним стискуванням структури.
Проявом цього є зменшення об’єму елементарної комірки при зростанні частки ковалентного, а також металевого зв’язку.
Найбільші міжатомні віддалі властиві водневому, а ще більші – вандерваальсівським зв’язкам.
Іонний зв’язок
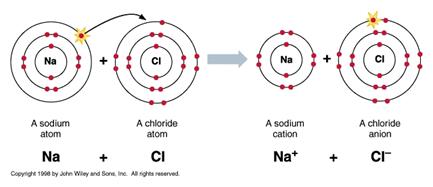
Іонний зв’язок встановлюється внаслідок електростатичної взаємодії між катіоном і аніоном, коли один атом віддає валентні електрони іншому. В результаті обидва атоми набувають заряд: один – додатній, другий – від’ємний.
Типові іонні сполуки складаються із катіонів металів І і ІІ груп періодичної системи і аніонів елементів VI і VII груп. Після формування зв’язку катіон і аніон набувають електронні конфігурації, аналогічні інертним газам. Для прикладу іон Na+ має конфігурацію неону 1s22s22p6, а іон Cl- - конфігурацію аргону 1s22s22p63s23p6.
| 
|
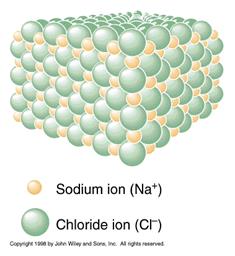
Рис. 4.10. Формування іонного зв’язку, кристалічна структура та карта електронної густини NaCl
Електронна хмара катіону розмита, тоді як аніонна хмара аніону має різкі границі із високим градієнтом густини.
Іонний зв’язок має кулонівську (електростатичну) природу і його сила зворотно пропорціональна довжини: чим більша віддаль між іонами – тим слабший зв’язок.
Іонний в значній мірі можна показати як ненаправлений, делокалізований. Чим зумовлена підвищена пластичність мінералів із іонним зв’язком, порівняно із ковалентним.
Іонний зв’язок властивий мінералам, що складені катіонами- лужними металами та аніонами-галогенами (галіт, сильвін, флюорит)
Дата добавления: 2015-05-21; просмотров: 1138;
