Реальные газы, уравнение Ван-дер-Ваальса.
Состояние реального газа нельзя описать с помощью уравнения Менделеева – Клапейрона, справедливого только для идеальных газов. Однако, если ввести в это уравнение поправки на силы взаимодействия между молекулами и собственный объём молекул, то можно получить уравнение, описывающее состояние реального газа. Такое уравнение было предложено Ван-дер-Ваальсом в 1873 году. Рассмотрим схему получения уравнения Ван-дер-Ваальса из уравнения Менделеева - Клапейрона для одного моля молекул газа 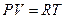 . Для перехода к уравнению состояния реального газа нужно учесть силы отталкивания, а, следовательно, собственный объём молекул. Для этого вводится поправка на молярный объём (или силы отталкивания) b. В СИ b измеряется в
. Для перехода к уравнению состояния реального газа нужно учесть силы отталкивания, а, следовательно, собственный объём молекул. Для этого вводится поправка на молярный объём (или силы отталкивания) b. В СИ b измеряется в 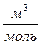 . Тогда получим уравнение состояния одного моля газа, учитывающее силы отталкивания между молекулами в виде:
. Тогда получим уравнение состояния одного моля газа, учитывающее силы отталкивания между молекулами в виде: 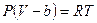 . Отсюда
. Отсюда 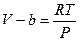 . Если увеличивать давление, то при
. Если увеличивать давление, то при 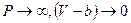 , следовательно, V=b . Отсюда виден физический смысл поправки b , заключающийся в том, что поправка на объём численно равна предельному объёму, который бы занял 1 моль реального газа при бесконечно большом давлении. Детальное рассмотрение даёт
, следовательно, V=b . Отсюда виден физический смысл поправки b , заключающийся в том, что поправка на объём численно равна предельному объёму, который бы занял 1 моль реального газа при бесконечно большом давлении. Детальное рассмотрение даёт 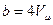 , то есть поправка на объём равна учетверённому объёму 1 моля молекул газа. Объём одной молекулы, считая её сферической, равен:
, то есть поправка на объём равна учетверённому объёму 1 моля молекул газа. Объём одной молекулы, считая её сферической, равен: 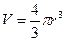 . Молярный объём
. Молярный объём 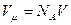 . Тогда поправка на объём выражена формулой:
. Тогда поправка на объём выражена формулой:
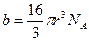 (10-1)
(10-1)
Учтём силы притяжения между молекулами газа, которые вызывают уменьшение давления на стенки сосуда на величину Pi , которую называют внутренним давлением газа. Молекулы, находящиеся в поверхностном слое газа (их число обратно пропорционально объёму), притягиваются ближайшими молекулами внутри газа (их число тоже обратно пропорционально объёму), следовательно, P i ~ n2 , а значит, P i ~ V – 2 . Можно записать равенство:
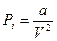 (10-2)
(10-2)
Здесь a – поправка на давление или силы притяжения, она различна для разных газов и в СИ измеряется в 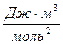 . Поправки a и b различны для разных газов. Учитывая обе поправки, получим:
. Поправки a и b различны для разных газов. Учитывая обе поправки, получим: 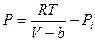 или
или 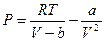 . Это уравнение описывает состояние реального газа. Однако, чаще всего, его записывают аналогично уравнению состояния идеальных газов, тогда уравнение состояние реальных газов для одного моля молекул имеет вид:
. Это уравнение описывает состояние реального газа. Однако, чаще всего, его записывают аналогично уравнению состояния идеальных газов, тогда уравнение состояние реальных газов для одного моля молекул имеет вид:
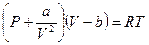 (10-3)
(10-3)
Уравнение состояния реального газа – уравнение Ван-дер-Ваальса - для любого количества вещества будет иметь вид:
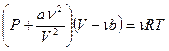 (10-4)
(10-4)
Дата добавления: 2015-04-15; просмотров: 1086;
